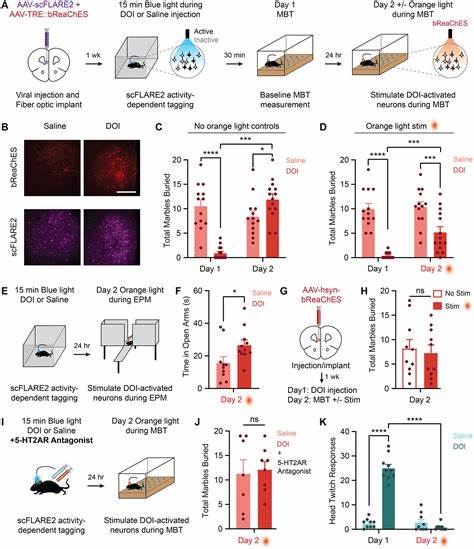
Psychedelika erfahren eine Renaissance in der Forschung, besonders im Hinblick auf ihre potenzielle therapeutische Wirkung bei neuropsychiatrischen Erkrankungen wie Angststörungen und Depressionen. Während viele Studien die positiven Effekte psychedelischer Substanzen auf verschiedene Verhaltensweisen belegen konnten, blieb lange Zeit unklar, welche neuronalen Mechanismen und Zelltypen genau für diese Effekte verantwortlich sind. Die neuartige Methode der Isolation psychedelischer-responsiver Neuronen bringt nun Licht ins Dunkel und eröffnet eine gezielte Betrachtung und Manipulation dieser spezifischen Zellen, die für die anxiolytischen (angstlösenden) Wirkungen der Substanzen verantwortlich sind.Im Zentrum dieser Forschung steht der mediale präfrontale Kortex (mPFC), eine Gehirnregion, die bei der Regulierung von Angst, Emotionen und Entscheidungsprozessen eine zentrale Rolle spielt. Das psychedelische Molekül 2,5-Dimethoxy-4-iodoamphetamin (DOI), ein Agonist des 5-HT2A-Serotoninrezeptors, zeigte in Experimenten mit Mäusen klare anxiolytische Effekte.
Forscher konnten durch eine Kombination aus molekularen und optogenetischen Techniken die Aktivität von Neuronen identifizieren und isolieren, die gezielt auf DOI reagieren. Die Möglichkeit, diese Zellen durch Licht zu reaktivieren, zeigte, dass die anxiolytische Wirkung von DOI ohne die typischen halluzinogenen Nebenwirkungen reproduziert werden kann. Dies gilt als ein großer Fortschritt, da bisher angenommen wurde, dass therapeutische Vorteile von Psychedelika untrennbar mit deren bewusstseinsverändernden Effekten verbunden sind.Die genutzte Methode beruht auf einem licht- und calciumabhängigen Aktivitätsintegrator, der es erlaubt, jene Neuronen genetisch zu markieren, die während der Verabreichung des Psychedelikums besonders aktiv sind. Anschließend erfolgt eine Einzelzell-RNA-Sequenzierung (snRNA-seq), die ein detailliertes molekulares Profil dieser Zellen liefert.
Überraschenderweise zeigte sich, dass nicht nur die 5-HT2A-Rezeptor-exprimierenden Neuronen aktiviert werden, sondern ein Netzwerk von verschiedenen Zelltypen beteiligt ist. Diese Erkenntnis erweitert das Verständnis psychedelischer Wirkmechanismen von einer rein rezeptorzentrierten Sicht hin zu einer komplexen Netzwerkanalyse.Darüber hinaus sind die Erkenntnisse von großer Bedeutung für die Entwicklung neuer Medikamente. Die aktuelle Herausforderung bei der Nutzung von Psychedelika in der Medizin besteht darin, die therapeutischen Effekte von den unangenehmen oder riskanten halluzinogenen Effekten zu trennen. Die Möglichkeit, spezifische neuronal aktivierte Populationen zu isolieren und zu manipulieren, könnte die Grundlage für nicht-halluzinogene Medikamente mit gleichzeitiger Angstreduzierender Wirksamkeit bilden.
Bereits gibt es vielversprechende Ansätze, analog zum DOI-Neuronen-Reaktivierungsexperiment, diese Zellen gezielt zu stimulieren.Die Anwendung dieser Forschung geht über die Grundlagenwissenschaft hinaus und zeigt potenzielle therapeutische Vorteile für eine Vielzahl von psychischen Erkrankungen. Angststörungen gehören zu den häufigsten psychischen Erkrankungen weltweit, die oft nur unzureichend mit klassischen Medikamenten behandelt werden können. Psychedelisch-induzierte neuroplastische Veränderungen, welche mit der Aktivierung spezifischer mPFC-Neuronen einhergehen, könnten dabei helfen, maladaptive Angstreaktionen zu überschreiben und nachhaltige therapeutische Effekte zu erzielen.Eine weitere spannende Facette liegt in der Kombination modernster Technologien.
Die Integration von optogenetischen Werkzeugen mit Einzelzell-Transkriptomanalysen stellt sicher, dass die Forschung auf einem molekularen wie zellbiologischen Level präzise verläuft. So gelingt es, nicht nur funktionelle, sondern auch genetische Eigenschaften psychedelischer-responsiver Neuronen zu charakterisieren, was die Grundlage für gezielte Gen- und Zelltherapien bildet.Zusammenfassend lässt sich sagen, dass die Isolation der psychedelischen-responsiven Neuronen im medialen präfrontalen Kortex ein bahnbrechender Fortschritt in der Neuropsychopharmakologie darstellt. Die Erkenntnisse bieten neue Perspektiven für die Entwicklung wirksamerer und sichererer Therapien gegen Angststörungen und andere neuropsychiatrische Krankheiten. Zugleich liefern sie wichtige Impulse für das Verständnis der komplexen neuronalen Netzwerke, die psychedelische Substanzen modulieren.
Angesichts der kontinuierlichen Zunahme psychischer Erkrankungen weltweit, könnte diese Forschung entscheidend dazu beitragen, neue, innovative und zielgerichtete Behandlungsansätze bereitzustellen, die sowohl wirksam als auch verträglich sind. Mit den Fortschritten der molekularen Markierung und Manipulation neuronaler Aktivität steht die Neurowissenschaft an der Schwelle zu einer neuen Ära, in der psychedelische Wirkmechanismen nicht nur besser verstanden, sondern auch gezielt therapeutisch genutzt werden können. Die Möglichkeit, therapeutische Effekte ohne die oft unerwünschten halluzinogenen Erlebnisse zu erzielen, verspricht nicht nur eine höhere Akzeptanz, sondern auch eine größere Sicherheit im klinischen Einsatz psychedelischer Substanzen. Die Zukunft der Angsttherapie könnte daher maßgeblich von der präzisen Isolation und Kontrolle spezifischer neuronaler Populationen abhängen, wie sie die aktuelle Forschung ermöglicht.



![Gemini Credit Card ® Review [2025]: Are Crypto Rewards Worth It?](/images/E40DD5E2-BD57-43F1-988E-0C337D0AE394)