Krebs zählt zu den weltweit führenden Todesursachen und stellt nach wie vor eine der größten Herausforderungen in der modernen Medizin dar. Trotz der Fortschritte in der Chirurgie, Chemotherapie, Strahlentherapie und Immuntherapie bleibt die Suche nach innovativen, weniger invasiven und gezielten Methoden zur Bekämpfung von Tumorerkrankungen von höchster Bedeutung. In den letzten Jahren hat sich ein völlig neuer Therapieansatz herauskristallisiert: die Nutzung genetisch modifizierter Adipozyten, um das Tumorwachstum zu unterbinden. Diese revolutionäre Technik beruht auf einem tiefgreifenden Verständnis der Tumormikroumgebung und des zellulären Stoffwechsels und bietet eine nachhaltige Alternative zu herkömmlichen Behandlungsmethoden. Adipozyten, umgangssprachlich als Fettzellen bekannt, spielen eine zentrale Rolle im Energiestoffwechsel des Körpers.
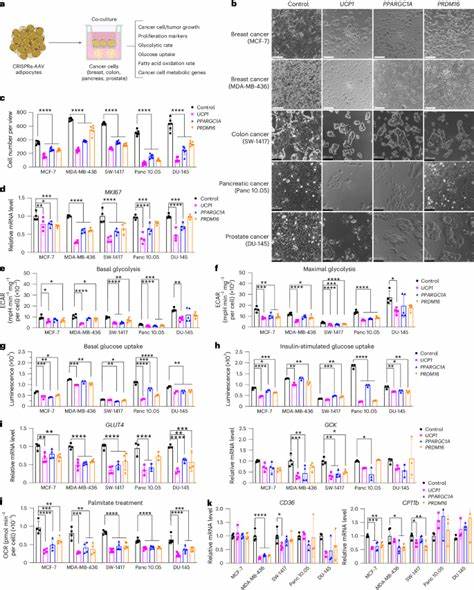
Sie speichern Fett und regulieren die Freisetzung von Energiereserven, wobei eine besondere Untergruppe, die sogenannten braunen Adipozyten, durch das Protein UCP1 Wärme erzeugen und somit Energie verbrauchen können. Forscher haben diese Eigenschaft genutzt und mittels CRISPR-basierter Genaktivierungstechnologie Adipozyten so verändert, dass sie erhöhte Mengen an Glukose und Fettsäuren aufnehmen und verarbeiten können. Diese gentechnisch modifizierten Zellen konkurrieren so effektiv um Nährstoffe mit den Tumorzellen, die für ihr rasches Wachstum auf hohe Energiezufuhr angewiesen sind. Durch die gezielte Überexpression von Genen wie UCP1, PPARGC1A und PRDM16, die kräftige Stoffwechselaktivitäten und die sogenannte „Browning“-Funktion von Fettzellen fördern, werden die Adipozyten quasi zu „Energieverbrauchern“. In Experimenten mit Zellkulturen, die diese modifizierten Adipozyten mit verschiedenen Krebszellen co-kultivierten, konnte erfolgreich eine signifikante Hemmung des Tumorzellwachstums nachgewiesen werden.
Besonderer Vorteil dieses Ansatzes liegt darin, dass die Adipozyten nicht direkt mit den Krebszellen in Kontakt treten müssen, sondern durch den Nährstoffentzug den Tumor indirekt schwächen. Tiermodelle haben die vielversprechende Wirkung dieser Methode weiter bestätigt. So führten Versuche an Immundefizienten Mäusen, in denen Tumorzellen zusammen mit den gentechnisch modifizierten Adipozyten implantiert wurden, zu einer drastischen Reduktion der Tumorgröße. Das behandelte Gewebe zeigte weniger Anzeichen von Hypoxie und einer verminderten Neubildung von Blutgefäßen, die typischerweise für das Tumorwachstum essentiell sind. Gleichzeitig waren die Anzeichen für einen gesteigerten Zelltod in den Tumoren erhöht, was auf die effiziente Unterbindung der Proliferation hinausläuft.
Eine wichtige Erkenntnis ist, dass die Wirkung der modifizierten Adipozyten durch das Nährstoffangebot des gesamten Organismus beeinflusst wird. Die Tumorsuppression war besonders effektiv bei Mäusen, die mit einer normalen Diät ernährt wurden, während eine Ernährung mit fettreichem Futter oder zusätzlichem Zuckerwasser diesen Effekt deutlich abschwächte. Das legt nahe, dass die therapeutische Wirksamkeit maßgeblich von der systemischen Nährstoffverfügbarkeit abhängt und dass zusätzliche Maßnahmen zur Regulierung des Stoffwechsels bei Patienten benötigt werden könnten. Neben der Implantation direkt in Tumornähe konnte das Verfahren auch bei Entfernung Implantationen Anwendung finden, was den Spielraum für chirurgische Eingriffe erheblich erweitert. Zudem wurde die Methode erfolgreich an genetisch veränderten Mausmodellen für Brust- und Bauchspeicheldrüsenkrebs angewandt, wodurch die Tumorprogression deutlich verlangsamt wurde.
Einen weiteren Meilenstein stellt die individuelle Anpassbarkeit dieser Methode dar. So kann beispielsweise durch die Überexpression von Uridindehydrolase (UPP1) in Adipozyten die Nutzung von Uridin, einem alternativen Nährstoff, der von bestimmten Tumoren genutzt wird, effektiv blockiert werden. Diese Flexibilität ermöglicht eine präzise Anpassung der Therapie an den jeweiligen metabolischen Bedarf verschiedener Tumortypen. Die Übertragung an humanes Gewebe wurde durch Experimente mit Adipozyten aus menschlichem Brustgewebe weiter untermauert. Diese Zellen konnten auch ex vivo so modifiziert werden, dass sie das Wachstum von patienteneigenen Tumororganoiden deutlich hemmen konnten.
Dieses Verfahren zeigt großes Potenzial, insbesondere in der Behandlung von Hochrisikopatientinnen mit genetisch bedingter Krebsprädisposition beispielsweise durch BRCA1 oder BRCA2 Mutationen. Ein weiterer Vorteil dieser Therapieform ist die Möglichkeit der reversiblen Steuerbarkeit. Durch den Einsatz von induzierbaren Systemen, die mit Medikamenten wie Tetracyclin angesteuert werden können, ist es möglich, die Aktivität der modifizierten Adipozyten präzise zu regulieren und so mögliche Nebenwirkungen zu minimieren. Darüber hinaus ermöglichen moderne Zellscaffold-Technologien die kontrollierte Implantation und Entfernung der Adiposeinheiten, was die Sicherheit und Flexibilität der Behandlung entscheidend erhöht. Die zellbiologische Basis dieser innovativen Therapie beruht auf der engen Nutzung der Stoffwechselwege.
Tumorzellen zeichnen sich durch eine erhöhte Glukoseaufnahme und eine bevorzugte Glykolyse auch unter aeroben Bedingungen aus – das sogenannte Warburg-Effekt. Ebenso bedienen sie sich verstärkt an der Fettsäureoxidation zur Energiegewinnung, insbesondere unter hypoxischen Bedingungen. Die gentechnisch manipulierten Adipozyten nutzen genau diese metabolischen Ressourcen, um sie den Tumorzellen vorzuenthalten, wodurch deren Wachstum erheblich gehemmt wird. Jedoch geht die Wirkung der modifizierten Adipozyten über die bloße Nährstoffkonkurrenz hinaus. Untersuchungen zeigen, dass die Therapie auch den systemischen Stoffwechsel positiv beeinflusst, etwa durch Senkung des Insulinspiegels und Verbesserung der Insulinsensitivität, was ebenfalls zu einer indirekten Verringerung der Tumorproliferation beiträgt.
Die Tatsache, dass adipöse Zustände und ein gestörter Stoffwechsel häufig mit einer schlechteren Krebsprognose assoziiert sind, unterstreicht die Bedeutung dieses ganzheitlichen therapeutischen Ansatzes. Die medizinische Relevanz der Adipozyten-Implantation wird durch die bereits etablierte Verwendung von Fettgewebe in der plastischen und rekonstruktiven Chirurgie ergänzt. Liposuktion und autologe Fetttransplantationen sind gängige Verfahren, die klinische Infrastruktur und Erfahrungswerte bieten. Die Möglichkeit, patienteneigene Fettzellen ex vivo mit CRISPRa-Technik zu modifizieren und anschließend zu implantieren, eröffnet somit einen sicheren und individualisierten Therapiepfad. Die Zukunftsperspektiven dieser Technologie sind vielversprechend.
Mögliche Erweiterungen umfassen die Kombination mit aktuellen Therapieformen, die Individualisierung anhand der metabolischen Charakteristika des Tumors und die Integration zusätzlicher funktionaler Modifikationen der Adipozyten, etwa die Sekretion antitumoraler Substanzen. Außerdem könnte durch weitere Forschung eine noch bessere Kontrolle der Adipozyten-Funktion und des Transplantationsortes erreicht werden, um klinische Anwendungen zu optimieren. Es bestehen zwar noch Herausforderungen, wie mögliche Auswirkungen von langfristiger Energieverbrauchsforderung auf den gesamten Organismus, die Gefahr einer potenziellen Kachexie oder Nebenwirkungen durch veränderte Hormonspiegel. Die eingebaute Möglichkeit der Induzierbarkeit und schnellen Entfernung der Therapieeinheiten gewährleistet jedoch hohe Sicherheit und Anpassungsfähigkeit. Insgesamt stellt die Implantation gentechnisch veränderter Adipozyten einen innovativen, naturbasierenden Ansatz im Kampf gegen Krebs dar.
Durch die Ausnutzung der zellulären Stoffwechselbalance bieten diese modifizierten Fettzellen eine neuartige und vielversprechende Strategie, das Fleisch gewordene „Schlupfloch“ der Tumore energetisch zu schließen und deren Wachstum fundamental zu hemmen. Damit könnten in Zukunft viele Patienten von einer effektiveren, verträglicheren und personalisierten Krebstherapie profitieren.