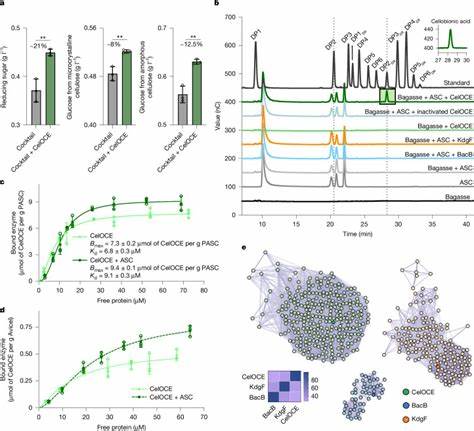
Cellulose ist die am häufigsten vorkommende organische Verbindung auf der Erde und stellt einen wesentlichen Bestandteil pflanzlicher Zellwände dar. Trotz ihrer Allgegenwart und Bedeutung als erneuerbare Rohstoffquelle stellt die enzymatische Umwandlung von Cellulose vor große Herausforderungen. Eine neue, wegweisende Entdeckung aus der Metagenomik bringt nun frischen Wind in die Forschung und industrielle Nutzung von Zelluloseabbau: Ein bislang unbekanntes metalloenzym aus dem genetischen Dunkel der Mikrobenwelt, auch als 'metagenomische Dunkelmaterie' bezeichnet, katalysiert die oxidative Spaltung von Cellulose auf eine ganz neuartige Weise. Diese Entdeckung könnte die industrielle Biomasseverarbeitung und die Entwicklung nachhaltiger biobasierter Produkte erheblich voranbringen. Die komplexe, mikrofasrige Struktur von Cellulose erschwert ihre biologische Verwertung.
Cellulose besteht aus langen Ketten von Glucosemolekülen, die eng in mikrofibrillären Aggregaten organisiert und mit Lignin sowie Hemicellulosen verknüpft sind. Diese Organisation macht Cellulose biochemisch schwer zugänglich und somit widerstandsfähig gegenüber enzymatischem Abbau. Traditionell basiert der biologische Celluloseabbau auf einem Zusammenspiel hydrolytischer Enzyme wie Endo-β-Glucanasen, Cellobiohydrolasen und β-Glucosidasen, die in Kombination die langen Celluloseketten in lösliche Zuckerbausteine zerlegen. Seit einigen Jahren ist bekannt, dass lytische Polysaccharid-Monooxygenasen (LPMOs) eine oxidative Komponente hinzufügen, indem sie mittels Redoxreaktionen und durch Kupfer als Kofaktor die Celluloseketten oxidativ spalten und so den Abbauprozess beschleunigen. Trotz intensiver Forschung sind jedoch viele mikrobielle Enzyme mit potenzieller Wirkung auf Cellulose noch unentdeckt oder bisher nicht charakterisiert, da ein Großteil mikrobieller Gemeinschaften in Laborbedingungen nicht kultiviert werden kann.
Dieser genetische und funktionelle 'Dunkelraum' der Mikrobiologie birgt enorme ungenutzte biochemische Kapazitäten. Die Metagenomik bietet hier moderne Werkzeuge, um aus Umweltproben die genetische Information dieser unbekannten Organismen zu entschlüsseln und daraus neue Enzyme zu entdecken. Forscherteams haben durch die Untersuchung von Bodenproben eines Zuckerrohr-Biowertstoffstapels, der seit Jahrzehnten dort lagert, eine einzigartige mikrobielle Gemeinschaft identifiziert, die spezialisiert auf den Abbau von lignozellulosehaltiger Biomasse ist. Die Analyse ihrer metagenomischen Daten deckte ein bislang unbekanntes bakterielles Genom auf, das mehrere Gene für Enzyme enthält, die an der Polysaccharidverwertung beteiligt sind, darunter sogenannte Glycosid-Hydrolasen. Innerhalb dieser genetischen Schatzkammer wurde ein ungewöhnliches Kupfer enthaltendes Enzym entdeckt, das keine typischen hydrolytischen Funktionen zeigte, jedoch unter reduktiven Bedingungen eine deutliche Steigerung der Cellulosezerlegung bewirkte.
Das Enzym wurde als 'CelOCE' bezeichnet – ein metalloenzymatischer Catalysator für die oxidative Celluloseumwandlung. Biochemische Untersuchungen zeigten, dass CelOCE in Anwesenheit von Sauerstoff und einem Elektronendonator ausschließlich cellobionsäure, ein oxidiertes Cellobiose-Derivat, aus Cellulose freisetzt. Dieses Produktmuster belegt, dass CelOCE einen neuartigen exo-typischen Oxidationsmechanismus besitzt, bei dem die Celluloseketten an ihren Enden selektiv oxidativ gespalten werden. Im Unterschied zu LPMOs befindet sich das katalytische Kupferatom nicht oberflächlich, sondern eingebettet in eine kompakte, jelly-roll-artige Proteinfaltung, die eine eigenständige H2O2-Generierung ermöglicht. Strukturanalysen mittels Röntgenkristallographie enthüllten, dass CelOCE als Homodimer vorliegt und zwei aktiv wirkende Kupferzentren besitzt, die auf gegenüberliegenden Seiten des Dimerstrukturs gespeichert sind.
Dieses Arrangement erlaubt es einem Subunit, Wasserstoffperoxid in situ zu erzeugen, während das andere Subunit mit Cellulose interagiert und die oxidative Spaltung katalysiert. Somit ist CelOCE in der Lage, das essentielle Peroxid zur Umsetzung der Redoxreaktion selbständig nahe am Substrat bereitzustellen – ein biochemischer Vorteil, der die enzymatische Aktivität effizient macht und Produktivität unter industriellen Bedingungen fördert. Die Bindungsaffinität von CelOCE zu verschiedenen Celluloseformen wurde mit mehreren Methoden validiert. Sowohl amorphe als auch mikrokristalline Cellulose werden fest gebunden, was die Spezifität des Enzyms für diese Substrate belegt. Interessanterweise zeigte CelOCE keine bindungs- oder aktiven Effekte auf andere Polysaccharide wie Xylan, Mannan oder Chitin, was auf eine hochselektive Funktion gegen Cellulose hinweist.
Funktionale Tests belegen weiterhin, dass die Zugabe von CelOCE zu einem schon industriell optimierten cellulolytischen Enzymcocktail aus dem Technologie-Klassiker Trichoderma reesei die Glucoseausbeute aus lignozellulosehaltiger Biomasse signifikant steigert. Besonders bemerkenswert ist, dass CelOCE mit Endo-Glucanasen synergistisch wirkt und die Gesamtsaccharifizierung um bis zu 20 % verbessern kann, ohne selbst hydrolytische Wirkung zu entfalten. Diese Kooperativität legt nahe, dass das oxidative Verfahren von CelOCE neue Enden erzeugt oder bestehende Polysaccharidstrukturen destabilisiert, wodurch hydrolytische Enzyme besser angreifen können. Aufgrund der kleinen Größe von CelOCE mit nur 115 Aminosäuren und dem einzigartigen Kupferbindungszentrum, unterscheidet sich das Enzym strukturell und funktionell von bekannten LPMOs. Es fehlt das charakteristische N-terminale Histidin, das bei LPMOs die Kupferkoordination übernimmt.
Diese Abweichung könnte neue Perspektiven für Proteinengineering eröffnen, um maßgeschneiderte Enzyme für spezifische biotechnologische Prozesse zu entwickeln. Die industrielle Relevanz von CelOCE wurde durch die Herstellung eines gentechnisch modifizierten Trichoderma reesei-Stamms validiert, der das Enzym über ein CRISPR/Cas9-System exprimiert. Das sekretierte Enzymgemisch zeigte unter bioreaktorbasierten Standardbedingungen (hohe Feststoffbeladung, relevante Temperatur und pH-Werte) eine signifikante Erhöhung des Glucoseertrags aus pflanzlicher Biomasse. Zudem gelang die Produktion in Pilotanlagen mit Volumina von 65 und 300 Litern, was die Skalierbarkeit und Anwendbarkeit in industriellem Maßstab unterstreicht. Diese Forschungsergebnisse eröffnen ein neues Kapitel im Verständnis der mikrobiellen Redoxbiochemie beim Celluloseabbau.
CelOCE demonstriert, dass Kupfer-basierte peroxygenase Reaktionen nicht auf LPMOs beschränkt sind, sondern auch in anderen Enzymfamilien vorkommen können. Sie erweitert das Spektrum bekannter enzymatischer Mechanismen, die der Natur dienen, um die schwer zugängliche pflanzliche Biomasse zu recyceln. Die Entdeckung bietet zudem vielversprechende Möglichkeiten für die nachhaltige Umwandlung von Agrarreststoffen in wertvolle Produkte und stärkt somit die bioökonomische Transformation in Zeiten des Klimawandels. Die Zukunft der Bioenergie und biobasierten Materialien hängt entscheidend von der effizienten Nutzung erneuerbarer Ressourcen ab. Enzyme wie CelOCE könnten dabei eine Schlüsselrolle einnehmen, indem sie in enzymatischen Cocktail-Formulierungen integriert werden, um kostengünstigere und umweltfreundlichere Prozesse für die Herstellung von Biokraftstoffen, Biokunststoffen und anderen biobasierten Chemikalien zu ermöglichen.
Weiterhin kann das Wissen über CelOCE als Vorlage für Design und Optimierung künstlicher Biokatalysatoren dienen, die speziell an industrielle Anforderungen angepasst sind. Abschließend symbolisiert die Entdeckung von CelOCE aus der metagenomischen Dunkelheit einen Meilenstein für die Biomolekularforschung, der die Bedeutung der Erforschung mikrobieller Diversität und unerkannter genetischer Ressourcen hervorhebt. Sie soll sowohl Grundlagenwissenschaftler als auch industrielle Anwender inspirieren, innovative Ansätze zu verfolgen, um die vielfältigen Potenziale der Natur zum Wohle nachhaltiger Technologien zu erschließen.