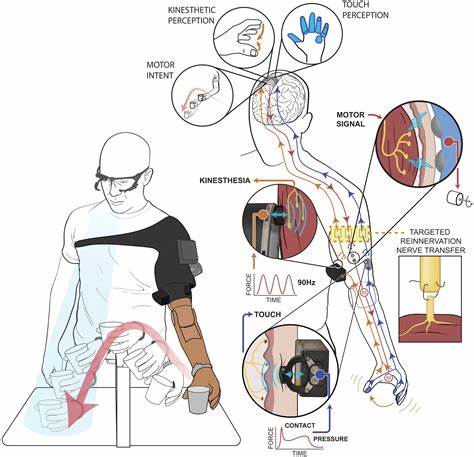
Die moderne Medizin und das Bioengineering erleben derzeit einen bedeutenden Paradigmenwechsel, der die Zukunft der Prothetik grundlegend verändern könnte. Wissenschaftler in führenden Forschungszentren wie der Universität Tokio und dem Institute for Bioengineering of Catalonia (IBEC) in Barcelona schreiten mit beeindruckenden Entwicklungen voran, die den Traum von lebenden Muskelprothesen Realität werden lassen. Anstatt herkömmliche, starre künstliche Gliedmaßen zu verwenden, arbeiten sie an biologischen Robotern, die aus menschlichem Muskelgewebe bestehen, sich natürlich bewegen und sogar regenerieren können. Diese Innovationen könnten nicht nur das Leben von Amputierten radikal verbessern, sondern auch neue Wege in der medizinischen Forschung, Therapie und Pharmakologie eröffnen. Eines der beeindruckendsten Projekte ist die Entwicklung eines 18 Zentimeter langen Arms, der vollständig aus menschlichem Muskelgewebe besteht und von Wissenschaftlern der Universität Tokio in Zusammenarbeit mit der Waseda Universität geschaffen wurde.
Diese lebende Prothese verfügt über fingerbewegliche Muskeln, die durch elektrische Impulse aktiviert werden und die komplexen Funktionen der menschlichen Hand nachahmen. Solche biologischen Arme sind eine Neuheit in der Welt der Biohybriden, da sie erstmals echte Muskelbewegungen ermöglichen, die über die bisherigen mechanisch gesteuerten Prothesen hinausgehen. Die Herausforderung bestand darin, ausreichend Muskelkraft zu erzeugen, um die Bewegung der verschiedenen Gelenke der Hand zu ermöglichen. Ein traditionelles Muskelgewebe war für diesen Zweck zu dick, wodurch die Versorgung mit Sauerstoff und Nährstoffen eingeschränkt wurde. Die Wissenschaftler lösten dieses Problem durch eine innovative Technik, bei der dünne Muskelschichten wie Sushi-Rollen zusammengerollt und zu komplexen Strukturen zusammengefügt werden.
Diese sogenannten Multi-Muscle Tissue Assemblies (MuMuTAs) gewährleisten eine hohe Lebensfähigkeit der Zellen und ermöglichen gleichzeitig Bewegungen, die für Alltagsfunktionen unerlässlich sind. Parallel zu japanischen Forschungen verfolgt das IBEC in Barcelona einen etwas anderen Ansatz mit 3D-Bioprinting-Technologien. Dort wird die innere Architektur von Muskelgewebe mit hoher Präzision nachgebildet. Mittels speziell entwickelter Bioinks, die lebende Zellen und biokompatible Materialien enthalten, gelingt es den Forschern, Muskelstrukturen nicht nur optisch originalgetreu, sondern auch funktional zu reproduzieren. Die Ausrichtung der Muskel-Fasern und ihre mikroskopische Organisation werden kontrolliert, um realistische Kontraktionsfähigkeit zu gewährleisten.
Dadurch eröffnen sich auch Einsatzmöglichkeiten jenseits der Prothetik, wie etwa in der Wirkstoffprüfung, der Altersforschung oder der Kosmetikindustrie. Die Bioprinting-Methode ermöglicht es darüber hinaus, die Empfindungen und Reaktionen von Muskelzellen auf Medikamente oder externe Reize zu simulieren. Solche lebenden Gewebemodelle sind präziser als traditionelle Tierversuchsmodelle und könnten zukünftig die Entwicklung neuer Therapeutika beschleunigen. Während die amerikanische FDA bereits begonnen hat, Bioprinting-Modelle als Alternative zu Tierversuchen zuzulassen, arbeitet die europäische Forschung noch daran, regulatorische Hürden abzubauen und diese Technologien breiter nutzbar zu machen. Trotz der beeindruckenden Fortschritte stehen die Forscher vor mehreren komplexen Herausforderungen.
Eine der größten Hürden ist die Vaskularisierung des Gewebes, also die Bildung und Integration von Blutgefäßen, die dafür sorgen, dass die Zellen zuverlässig Sauerstoff und Nährstoffe erhalten. Ohne eine funktionierende Gefäßversorgung überleben größere und dickere Muskelkörper nicht lange außerhalb des Labors. Ein medizinisch einsatzfähiges Organ oder eine Prothese muss daher eine integrierte Blutgefäßstruktur besitzen, die nach der Transplantation mit dem Körpersystem des Patienten verbunden wird – ein technologisches Ziel, das zurzeit noch in weiter Ferne liegt. Ein weiterer limitierender Faktor betrifft die Steuerung der Muskeln. Aktuell werden elektrische Impulse von externen Geräten gesetzt, die die Muskelkontraktion hervorrufen.
Für den Einsatz in echten Prothesen ist aber die Integration einer neuronalen Steuerung entscheidend, die Signale vom Gehirn oder dem peripheren Nervensystem empfängt und darauf reagiert. Das bedeutet, lebende Muskelprothesen müssten mit dem Nervensystem verbunden und in der Lage sein, auf natürlicheweise Bewegungsbefehle zu reagieren. Die Umsetzung dieser Schnittstelle stellt eine der wichtigsten Aufgaben der nächsten Forschungsjahre dar. Nicht zuletzt sind auch die Umweltbedingungen, unter denen ein lebendes Muskelgewebe außerhalb des Körpers funktionieren kann, eine technische Herausforderung. Die Temperatur muss stabil bei etwa 37 Grad Celsius gehalten werden und ein permanentes Nährstoffversorgungssystem benötigt werden, um die Zellen am Leben zu erhalten.
Hierfür werden spezielle Umgebungsgehäuse entwickelt, die die Bedingungen eines biologischen Milieus so realistisch wie möglich nachbilden können. Zudem muss die gesamte Konstruktion robust und alltagstauglich sein, um im echten Leben bestehen zu können. Während die Wissenschaft also auf dem Weg ist, lebende Muskeln in Prothesen zu integrieren, werden Parallelentwicklungen bei sogenannten biobotischen Systemen vorangetrieben, bei denen organische Gewebe mit elektronischen Komponenten verbunden werden. Diese sogenannten Biohybriden vereinen die Vorteile biologischer Beweglichkeit und Selbstheilung mit der Präzision digitaler Steuerungen. Die Vision von Prothesen, die sich nicht nur wie echte Körperteile anfühlen und bewegen, sondern sich bei Bedarf auch regenerieren, könnte so bald Realität werden.
Die gesellschaftliche Bedeutung solcher Technologien ist enorm. Für Menschen, die eine Amputation erlitten haben, bedeutet eine lebende Muskelprothese eine Rückkehr zu einer natürlichen, fließenden Motorik und damit eine deutlich höhere Lebensqualität. Neben der gesteigerten Funktionalität trägt die Verwendung eigener Zellen zur besseren Verträglichkeit bei, was Abstoßungsreaktionen minimiert. Außerdem eröffnen sich neue Chancen für die Rehabilitation und das Training: Künstliche Muskeln könnten durch gezielte Stimulation trainiert und ausgebaut werden, ähnlich wie echte Körpermuskeln. Über die reine Prothetik hinaus können diese Entwicklungen erhebliche Auswirkungen auf die biomedizinische Forschung haben.
Laborgezüchtete Muskelmodelle eignen sich hervorragend für die Untersuchung von Krankheiten wie Muskeldystrophien oder altersbedingtem Muskelschwund und ermöglichen gleichzeitig die Erprobung individueller Therapien. Die Möglichkeit, biologische Modelle zu personalisieren, indem beispielsweise Zellen des jeweiligen Patienten verwendet werden, führt zu einer maßgeschneiderten Medizin, die Symptome besser bekämpft und Nebenwirkungen reduziert. Trotz der großen Fortschritte ist die Technologie noch nicht marktreif. Experten sind sich einig, dass es weitere Jahre intensiver Forschung benötigt, um alle technischen, biologischen und ethischen Herausforderungen zu bewältigen. Die Zusammenarbeit internationaler Teams, die Integration modernster Bioprinting-Technologien, Tissue-Engineering und neurophysiologischer Steuerungssysteme wird entscheidend sein, um das volle Potenzial lebender Muskelprothesen auszuschöpfen.
Insgesamt zeichnen sich in der Prothetik spannende neue Wege ab, die Mozarts Traum von einer Symbiose von Mensch und Maschine nicht nur in der Theorie, sondern greifbar und anwendungsbereit machen. Lebende Muskelprothesen könnten nicht nur die Grenzen zwischen biologischem Gewebe und künstlichen Materialien überwinden, sondern auch die Art und Weise revolutionieren, wie wir über Heilung, Reparatur und Wiederherstellung menschlicher Funktionen denken. Die neuesten Forschungserfolge in Barcelona, Tokio und anderen Innovationszentren bilden dabei den Grundstein für eine medizinische Revolution, die sowohl Patienten als auch Wissenschaftlern neue Perspektiven eröffnet.