Die moderne Arzneimittelforschung steht vor einer Vielzahl von Herausforderungen, die von hohen Kosten bis hin zu langwierigen Entwicklungszeiten reichen. Innovationen in den Bereichen Künstliche Intelligenz und Biotechnologie bieten jedoch enorme Chancen, um diese Hürden zu überwinden. Besonders die Kombination von Low-Data Machine Learning (ML) mit der Forschung an Schneckengiften hat das Potenzial, die Wirkstoffentwicklung fundamental zu verändern und zu beschleunigen. Während konventionelle Machine Learning Modelle große Datenmengen benötigen, um präzise Vorhersagen zu treffen, ermöglicht Low-Data ML auch mit wenigen verfügbaren Datensätzen aussagekräftige Erkenntnisse. Das ist besonders relevant in Bereichen, in denen umfangreiche Datensammlungen noch nicht existieren, wie bei der Erforschung natürlicher Gifte aus seltenen Organismen.
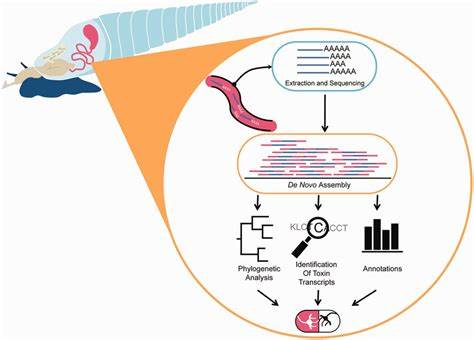
Schnecken, insbesondere marine Arten, produzieren eine Vielfalt an bioaktiven Verbindungen, die als chemische Verteidigungsmechanismen dienen. Viele dieser Verbindungen haben das Potenzial, als Wirkstoffe für neue Medikamente eingesetzt zu werden, beispielsweise zur Behandlung von Schmerzen, neurologischen Erkrankungen oder Krebs. Die Herausforderung liegt jedoch darin, diese komplexen Moleküle systematisch zu analysieren und ihre Wirkung vorherzusagen. Hier kommt Low-Data Machine Learning ins Spiel. Durch die Kombination biologischer Daten mit fortgeschrittenen ML-Techniken lassen sich Muster und Zusammenhänge erkennen, die mit herkömmlichen Methoden nur schwer zugänglich wären.
Ein Beispiel dafür ist die Nutzung von Modellen, die speziell darauf ausgelegt sind, auch bei begrenzten Datensätzen präzise Vorhersagen zur Molekülaktivität zu treffen. Dies beschleunigt den Prozess der Wirkstoffidentifizierung erheblich. Die Integration von Low-Data ML in die Wirkstoffforschung bietet zudem den Vorteil, dass sie kosteneffizienter und nachhaltiger ist. Traditionelle experimentelle Methoden erfordern oft umfangreiche Labortests und Materialien, die zeitaufwendig und teuer sind. Durch die gezielte Auswahl und Modellierung potenzieller Wirkstoffe auf Basis von ML-Prognosen können Forschungsteams Ressourcen gezielter einsetzen und Fehlversuche reduzieren.
Marine Schneckengifte sind hierbei besonders vielversprechend. Sie enthalten oft Peptide, die hochselektiv und stark wirksam sind, was sie für therapeutische Anwendungen spannend macht. Ein bekannter Wirkstoff, der auf Schneckengift basiert, ist Ziconotid, ein starkes Schmerzmittel, das aus dem Gift der Conus magus-Schnecke gewonnen wird. Diese Erfolgsgeschichte zeigt, wie wertvoll natürliche Stoffe in der Arzneimittelforschung sein können. Gleichzeitig verdeutlicht sie aber auch, wie aufwendig die Entwicklung und das Verständnis solcher Verbindungen sind.
Low-Data ML hilft dabei, diese Komplexität schneller zu durchdringen und neue Wirkstoffe zu identifizieren, bevor sie in aufwändige klinische Studien gehen. Forschungseinrichtungen und Pharmaunternehmen investieren daher zunehmend in Projekte, die genau diese Kombination aus Data Science und Bioaktivitätsforschung vorantreiben. Die Herausforderung liegt weiterhin darin, die Modelle zuverlässig zu trainieren und zu validieren, da biologische Systeme komplex und oft nicht vollständig verstanden sind. Dennoch zeigen erste Studien vielversprechende Ergebnisse, bei denen mit minimalen Datensätzen doch erstaunliche Vorhersagen getroffen werden konnten. Darüber hinaus können ML-gestützte Ansätze helfen, Nebenwirkungen frühzeitig zu erkennen oder die pharmakokinetischen Eigenschaften von Molekülen zu optimieren.
Dies verbessert nicht nur die Sicherheit der Medikamente, sondern erhöht auch ihre Wirksamkeit. In einem weiteren Schritt kann die Kombination aus Low-Data Machine Learning und Schneckengiftforschung als Vorlage dienen, um auch andere natürliche Ressourcen effizient zu erschließen. Pflanzen, Mikroorganismen oder andere Meereslebewesen bieten eine Fülle unbekannter bioaktiver Substanzen, deren Potenzial mithilfe datenbasierter Methoden schneller zu Tage gefördert werden kann. Die Verbindung von Biologie, Chemie und Artificial Intelligence ist somit ein zentraler Treiber der nächsten Generation von Medikamentenentwicklungen. Insgesamt zeigt sich, dass selbst mit limitierten Datenanalysen innovative ML-Methoden die Arzneimittelforschung revolutionieren können.