Krebs gilt weiterhin als eine der größten Herausforderungen der modernen Medizin. Trotz zahlreicher Fortschritte in der Forschung und Therapie bleiben viele aggressive Krebserkrankungen schwer behandelbar, insbesondere solche, die bei Kindern auftreten. Diese Arten von Krebs unterscheiden sich häufig biologisch stark von erwachsenen Tumoren, was die Entwicklung spezifischer Therapien erschwert. Ein vielversprechender neuer Ansatz in der Krebsbehandlung sind sogenannte Protein-Slayer Medikamente, die durch gezielte Zerstörung von krankheitsverursachenden Proteinen völlig neue Wege eröffnen könnten. Protein-Slayer Medikamente basieren auf einem innovativen Wirkprinzip, das sich von traditionellen Arzneimitteln grundlegend unterscheidet.
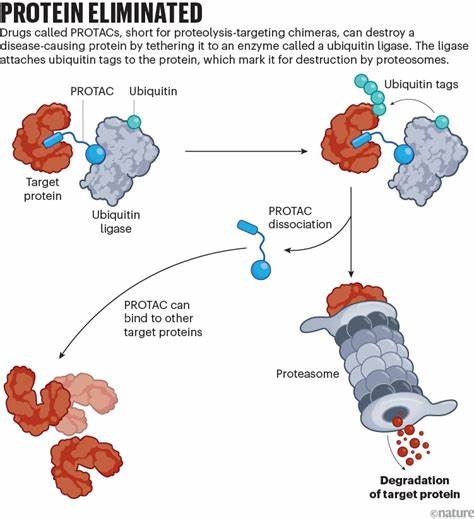
Während konventionelle Medikamente meist darauf abzielen, die Funktion eines Proteins zu hemmen, indem sie dessen aktive Stelle blockieren, gehen Protein-Slayer noch einen Schritt weiter. Sie beseitigen das krankheitsauslösende Protein komplett aus der Zelle. Dies geschieht durch die Ausnutzung der natürlichen zellulären Mechanismen, die für den Proteinabbau zuständig sind. Diese Wirkstoffe, auch bekannt als PROTACs (Proteolysis-Targeting Chimeras), verbinden das Zielprotein mit einem Enzym, das das markierte Protein mit sogenannten Ubiquitin-Molekülen versieht. Diese Markierung signalisiert der Zelle, das Protein zu zerstören.
Auf diese Weise wird das unerwünschte Protein vollständig eliminiert, anstatt nur seine Aktivität zu blockieren. Dieser Mechanismus hat den entscheidenden Vorteil, dass er auch jene Proteine angreifen kann, die lange Zeit als „undruggable“ galten, also für traditionelle Medikamente nicht zugänglich sind. Die Herausforderung bei der Entwicklung von PROTACs lag lange Zeit darin, geeignete Moleküle zu finden, die klein genug sind, um in die Zelle einzudringen, und gleichzeitig effektiv die Verbindung zwischen Zielprotein und Abbau-Enzym herstellen können. Fortschritte in der Chemie und Molekularbiologie haben diese Hürden jedoch überwunden. Seit 2019 durchlaufen mehrere PROTAC-Kandidaten klinische Studien, hauptsächlich bei verschiedenen Krebsarten, aber auch anderen Erkrankungen wie Parkinson und Entzündungskrankheiten.
Besonders spannend sind neue Ansätze für die Behandlung von soliden Tumoren bei Kindern, die bislang kaum effektive und gut verträgliche Therapieoptionen hatten. Kindliche Krebserkrankungen sind in vielerlei Hinsicht einzigartig. Sie entstehen häufig aus genetischen Fehlfunktionen, wie etwa der Bildung sogenannter Fusionsproteine, die durch das fehlerhafte Verschmelzen zwei verschiedener Gene entstehen. Diese Fusionen gelten als direkte Ursache vieler aggressiver Tumorerkrankungen bei Kindern, darunter neuroblastomartige Tumoren, Ewing-Sarkome und seltene Lebertumore. Das Problem ist, dass solche Proteine oft keine klassischen Bindungsstellen für Medikamente aufweisen.
Die Fähigkeit von PROTACs, diese „undruggables“ dennoch zu eliminieren, eröffnet neue Perspektiven. Ein besonders tragisches Beispiel, das den dringenden Bedarf an neuen Therapien verdeutlicht, ist die Geschichte des kleinen Evan Lindberg. Er wurde mit nur drei Jahren an Neuroblastom diagnostiziert – einer aggressiven Form von Nervengewebskrebs, der sich bereits im Körper ausgebreitet hatte. Trotz intensiver Behandlungen mit Chemotherapie, Chirurgie und Immuntherapie verstarb Evan im Alter von sieben Jahren. Für seinen Vater war dies eine Motivation, gemeinsam mit führenden Forschern an besseren Lösungsansätzen zu arbeiten.
Durch diese Zusammenarbeit wurden gezielte Forschungsprojekte ins Leben gerufen, die sich auf die Bekämpfung von Proteinen wie MYCN konzentrieren – einem Transkriptionsfaktor, der das Zellwachstum massiv antreibt und bislang als unantastbar galt. Die Arbeit von Wissenschaftlern wie Yael Mossé vom Children’s Hospital of Philadelphia sowie internationalen Teams in Deutschland, Großbritannien, Österreich und Frankreich symbolisiert den wachsenden Einsatz, Kinderkrebs durch Proteinabbau besser zu behandeln. Unter dem Namen KOODAC (Knocking Out Oncogenic Drivers And Curing Childhood Cancers) werden mehrere PROTAC-Projekte verfolgt, die neben MYCN auch weitere Krebsproteine ins Visier nehmen. Ziel ist es nicht nur, die Wirksamkeit der Medikamente zu gewährleisten, sondern auch den Zugang zu erschwinglichen und einfach anzuwendenden Therapien zu ermöglichen. Dies ist besonders wichtig, da viele Familien in Mittel- und Niedrig-Einkommensländern heute oft gezwungen sind, teure Behandlungen abzubrechen.
Nicht nur bei kindlichen Krebsarten wächst das Vertrauen in die Proteinabbau-Technologie. Pharmafirmen rund um den Globus investieren stark in die Entwicklung von PROTACs, die bereits bei Brust-, Prostata- und Blutkrebserkrankungen klinisch getestet werden. Die bisher fortschrittlichsten Kandidaten haben Phase-III-Studien erreicht – die letzte Hürde vor einer möglichen Markteinführung. Dies zeigt, dass sich Proteinabbau-Therapien von einem anfänglichen Laborexperiment zu einer neuen Therapiewelle entwickelt haben. Ein weiterer großer Vorteil der Protein-Slayer Medikamente ist ihre sehr gezielte Wirkweise kombiniert mit der Fähigkeit, auch komplexe Proteinfunktionen vollständig auszuschalten.
Manche Proteine sind an Krankheiten auf mehreren Ebenen beteiligt. Während traditionelle Hemmstoffe oft nur einzelne Funktionen blockieren, beseitigen PROTACs das ganze Protein. Dadurch lässt sich die Krankheit womöglich effektiver kontrollieren, und es besteht die Hoffnung, Resistenzmechanismen der Krebszellen zu umgehen oder zu verzögern. Die Proteinabbau-Technologie steht auch für eine neue Generation von Arzneimitteln, welche die überlebenswichtige zelluläre Maschinerie nutzt, anstatt sie zu umgehen. Es handelt sich um eine hochgradig innovative Methode, die in den nächsten Jahren voraussichtlich nicht nur bei Krebs, sondern auch bei anderen Krankheiten wie neurodegenerativen Störungen und Entzündungen Anwendung finden wird.
Dennoch gibt es noch Herausforderungen. Die Komplexität der Wirkmechanismen erfordert umfangreiche Forschung: Wie genau beeinflussen PROTACs verschiedene Zelltypen? Wie vermeidet man unerwünschte Nebenwirkungen? Und wie lässt sich die langfristige Sicherheit gewährleisten? Zudem brauchen Patienten und Gesundheitssysteme Zeit, um sich auf diese neue Art der Behandlung einzustellen. Nichtsdestotrotz bringt der aktuelle Stand der Forschung viel Hoffnung. Das Beispiel von Evan Lindberg erinnert uns daran, wie dringend wir neue, gezieltere und verträglichere Therapien für besonders aggressive Krebserkrankungen benötigen. Protein-Slayer Medikamente könnten schon bald ein wichtiger Baustein im Kampf gegen die schlimmsten Formen von Krebs werden und neue Perspektiven für Patienten aller Altersgruppen eröffnen.
Insgesamt zeigt sich, dass der Bereich der gezielten Proteinzerstörung eine der spannendsten Fronten moderner Krebsforschung ist. Mit zunehmenden klinischen Studien, wachsender pharmazeutischer Unterstützung und internationalen Forschungskooperationen nimmt die Aussicht zu, dass viele bislang unheilbare Krankheiten künftig effektiver behandelt werden können. Diese Entwicklung wird von Patienten, Angehörigen und Forschern gleichermaßen mit großer Erwartung verfolgt – und könnte die Krebsbehandlung nachhaltig revolutionieren.