Die Erforschung neuer Therapiemöglichkeiten gegen Krebs steht im Mittelpunkt moderner medizinischer Forschung. Insbesondere die Bedeutung des Tumormikromilieus und der Stoffwechselveränderungen bei Krebszellen rückt immer stärker in den Fokus. Ein vielversprechender Ansatz ist die Nutzung von gentechnisch veränderten Adipozyten, also Fettzellen, die gezielt modifiziert werden, um das Tumorwachstum zu hemmen. Aktuelle Forschungsergebnisse zeigen, dass durch die Implantation solcher modifizierter Adipozyten die Progression von Tumoren in verschiedenen Krankheitsmodellen maßgeblich unterdrückt werden kann. Diese neue Methode erweitert das Spektrum krebsbezogener Therapien und bietet potenziell einen innovativen Weg zur Behandlung unterschiedlicher Krebsarten.
Krebszellen zeichnen sich durch einen erhöhten Energie- und Nährstoffbedarf aus. Im Gegensatz zu normalen Zellen können sie ihre Stoffwechselwege umprogrammieren, um gezielt Nährstoffe wie Glukose und Fettsäuren effizienter zu nutzen. Dieses Phänomen, auch bekannt als der Warburg-Effekt, beschreibt die bevorzugte Nutzung von aerober Glykolyse durch Krebszellen, selbst bei ausreichender Sauerstoffversorgung. Darüber hinaus greifen Krebszellen unter hypoxischen Bedingungen verstärkt auf Lipide zurück, welche mehr Energie liefern als Glukose. Vor diesem Hintergrund ist es von besonderem Interesse, therapeutische Strategien zu entwickeln, die genau diese Stoffwechselwege stören und somit das Wachstum der Tumorzellen einschränken.
Die gezielte Modifikation von Adipozyten nutzt diese besonderen metabolischen Eigenschaften aus. Weiße Fettzellen können durch genetische Aktivierung bestimmter Schlüsselmoleküle in eine braune Fettzell-ähnliche Form umgewandelt werden, was als „Browning“ bezeichnet wird. Braune Adipozyten besitzen die Fähigkeit, große Mengen an Glukose und Fettsäuren aufzunehmen und zur Wärmeproduktion zu verwenden, wobei sie sogenannte Entkopplungsproteine wie UCP1 hochregulieren. Durch dieseEigenschaft können braune oder „beige“ Adipozyten den Tumoren Nährstoffe entziehen und so deren Wachstum deutlich hemmen. Die Implementierung dieser biotechnologischen Fortschritte erfolgt mithilfe modernster Geneditierungstechniken wie CRISPRa (CRISPR Activation).
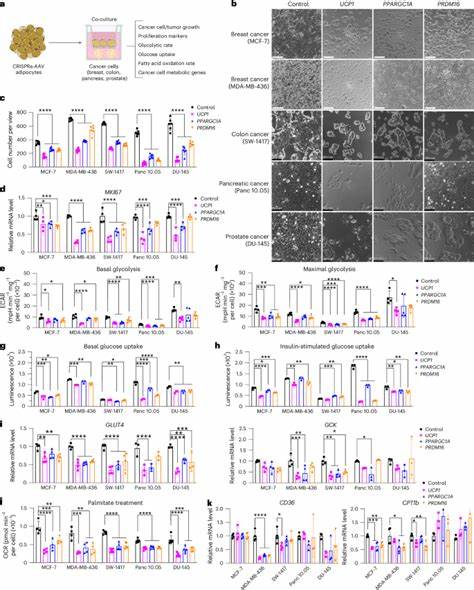
Dabei wird gezielt die Aktivierung von Genen wie UCP1, PPARGC1A und PRDM16 angestoßen, die maßgeblich für das Browning von Fettzellen verantwortlich sind. Durch die Transduktion von humanen weißen Adipozyten mit Adeno-assoziierten Viren (AAV) werden diese Gene aktiviert und die Zellen metabolisch umprogrammiert. Diese modifizierten Adipozyten besitzen eine erhöhte Stoffwechselaktivität, die sich in gesteigerter Glukoseaufnahme und Fettsäureoxidation widerspiegelt. Experimentelle Studien mit verschiedenen Krebszelllinien – darunter Brust-, Darm-, Pankreas- und Prostatakarzinome – belegen, dass die Ko-Kultivierung mit CRISPRa-modifizierten Adipozyten das Tumorwachstum signifikant reduziert. Dabei sinken die Zellzahlen der Krebszellen um das Drei- bis Fünffache.
Gleichzeitig wird die Expression von Proliferationsmarkern wie MKI67 in den Tumorzellen verringert. Zudem zeigen die Krebszellen nach der Ko-Kultivierung eine deutliche Reduktion der Glykolyse und Fettsäureoxidation, was auf die Nährstoffkonkurrenz mit den modifizierten Adipozyten zurückzuführen ist. In vivo-Modelle setzen diesen Ansatz erfolgreich um, indem modifizierte Adipozyten-Organoide zusammen mit Tumorzellen in immunsupprimierte Mäuse implantiert werden. Diese Organoide bilden ein dreidimensionales Gewebe, das die Heterogenität und Funktion natürlicher Fettgewebe besser nachbildet. Die Ergebnisse sind vielversprechend: Alle getesteten Tumorarten zeigen ein um über 50 Prozent verringertes Wachstum, reduziert hypoxische Bereiche, verminderte Angiogenese und erhöhte Apoptoseraten.
Besonders bemerkenswert ist, dass die Implantation der modifizierten Adipozyten sowohl direkt neben dem Tumor als auch an entfernteren Stellen im Körper wirkt, was die klinische Anwendbarkeit erleichtert. Stoffwechselanalysen untermauern das Wettbewerbsmodell zwischen Tumor und modifizierten Adipozyten. Die implantierten braunen Adipozyten nehmen vermehrt Glukose und Fettsäuren auf und vermindern so deren Verfügbarkeit für die Tumorzellen. In Experimenten mit erhöhter Nahrungszufuhr, etwa durch fett- oder zuckerreiche Diäten, lässt sich dieser Effekt deutlich abschwächen, was die zentrale Bedeutung der Nährstoffkonkurrenz belegt. Durch das gezielte Verknappen dieser Ressourcen wird das Tumorwachstum effektiv gehemmt.
Zur weiteren Ausweitung des Einsatzspektrums dieser Technologie wurde erfolgreich der Uridinphosphorylase-1 (UPP1) Gen-Expressor in Adipozyten mittels CRISPRa aktiviert. Dies führt zu einer gesteigerten Aufnahme von Uridin, einem wichtigen Nukleotidvorläufer, das von Pankreas-Duktaladenokarzinomen (PDA) genutzt wird. Somit kann ein uridinabhängiger Tumor in seiner Versorgung über diesen Stoffwechselweg manipuliert und sein Wachstum eingeschränkt werden. Dieses Beispiel demonstriert nicht nur die Wirksamkeit des Konzepts, sondern auch seine Anpassungsfähigkeit an unterschiedliche metabolische Abhängigkeiten verschiedener Krebsarten. Neben den experimentellen Modellen wurde die Technik auch auf humanem Gewebe erprobt.
Fettgewebe aus operativ gewonnenem Brustgewebe wurde ex vivo modifiziert und erfolgreich mit Tumororganoiden von Brustkrebspatienten ko-kultiviert. Auch hier zeigte sich eine deutliche Hemmung des Tumorwachstums und eine Verringerung der Zellproliferation. Dies unterstreicht die potenzielle Anwendbarkeit der Methode in einer klinischen Umgebung. Insbesondere für Brustkrebspatientinnen könnte die AMT (adipose manipulation transplantation, adipöse Manipulationstransplantation) in Kombination mit rekonstruktiven Operationen eine innovative Behandlungsoption darstellen. Ein weiteres wichtiges Element der Translation in die Klinik ist die Kontrollierbarkeit der Genaktivierung.
Über einen induzierbaren CRISPRa-System, das mithilfe von Tetracyclin regulierbar ist, können die Expressionen der Zielgene zeitlich und dosisabhängig gesteuert werden. Dies ermöglicht eine Anpassung an die individuellen Bedürfnisse der Patienten und bietet Sicherheit durch die Möglichkeit, die therapeutische Aktivität zu pausieren oder zu beenden. Auch die Implementierung eines biokompatiblen Cell-Scaffold-Systems, in dem die modifizierten Adipozyten-Organoide mittels Polymergerüsten stabil gehalten und in kontrollierter Weise implantiert werden können, stellt einen Fortschritt dar. Dieses System erlaubt zudem, das Gewebe problemlos zu entfernen oder zu ersetzen, um flexibel auf Veränderungen im Tumormikromilieu zu reagieren oder verschiedene tumorassoziierte Stoffwechselwege gezielt zu adressieren. Die Bedeutung des AMT-Ansatzes liegt nicht nur in der direkten Tumorsuppression sondern auch in seiner möglichen Wirkung auf den gesamten Organismusstoffwechsel.
Studien zeigen, dass aktivierte braune Adipozyten die Insulinspiegel senken und die Glukosetoleranz verbessern können. Da Hyperinsulinämie als mitverantwortlich für Tumorwachstum gewertet wird, könnte dieser zusätzliche Effekt die Anti-Tumor-Wirkung unterstützen und das therapeutische Potenzial erweitern. Aus klinischer Sicht bietet die Verwendung von Adipozyten, die durch bereits etablierte Verfahren wie Liposuktion gewonnen und nach genetischer Modifikation implantiert werden können, ein überschaubares und verhältnismäßig risikoarmes Verfahren. Die niedrige Immunogenität von Fettzellen erleichtert zudem die Möglichkeit, allogene oder „Off-The-Shelf“-Produkte zu entwickeln. Der Einsatz von Organoiden und Zellgerüsten eröffnet perspektivisch individuelle Therapieoptionen, die sowohl metabolische Besonderheiten des Tumors als auch Patientenfaktoren berücksichtigen.



![The inarguably best rhythm [video]](/images/7A2D36DE-2335-428C-BAE3-6DD429D13C27)