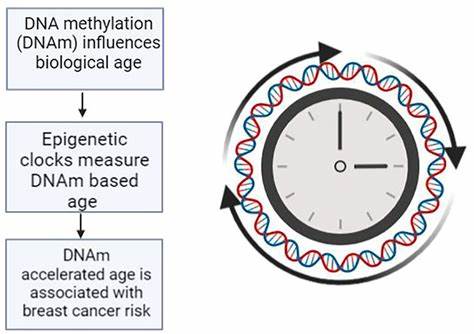
Alzheimer ist eine der größten Herausforderungen der modernen Medizin und betrifft weltweit Millionen von Menschen. Die Suche nach frühen diagnostischen Methoden und verlässlichen Biomarkern, die das Fortschreiten der Krankheit vorhersagen können, ist von zentraler Bedeutung. Ein bahnbrechender Ansatz dabei ist die Untersuchung des sogenannten epigenetischen Alters anhand der DNA-Methylierung aus peripherem Blut. Diese Methode basiert auf der Erkenntnis, dass unser biologisches Alter nicht immer mit dem chronologischen Alter übereinstimmt, und dass spezifische epigenetische Veränderungen Aufschluss über die Gesundheit und das Altern des Gehirns geben können. Epigenetik beschreibt Veränderungen an der DNA, die die Genaktivität beeinflussen, ohne die genetische Sequenz selbst zu verändern.
Besonders die Methylierung von DNA-Strängen spielt in der Steuerung von Genexpression eine entscheidende Rolle. Im Laufe des Lebens ändern sich diese Methylierungsmuster, und diese Veränderungen können durch sogenannte epigenetische Uhren gemessen werden. Zwei der derzeit vielversprechendsten Modelle sind DNAmPhenoAge und DNAmGrimAge. Beide sind präzise Algorithmen, die anhand bestimmter Methylierungsmuster das biologische Alter schätzen und wichtige Gesundheitsrisiken ableiten können. Eine aktuelle Studie mit über 400 Probanden im Rahmen der Alzheimer’s Disease Neuroimaging Initiative (ADNI) hat gezeigt, dass das epigenetische Alter, berechnet aus Blutproben, ein starker Prädiktor für die Progression von kognitiv normalen Menschen zu leichter kognitiver Beeinträchtigung (MCI) oder Alzheimer ist.
Dabei konnte gezeigt werden, dass Probanden mit einem beschleunigten epigenetischen Alter ein höheres Risiko hatten, innerhalb weniger Jahre eine Verschlechterung ihrer kognitiven Leistungsfähigkeit zu erfahren und diagnostisch in Richtung Alzheimer zu fallen. Interessanterweise zeigte sich, dass die Messgrößen DNAmPhenoAge und DNAmGrimAge in unterschiedlichem Maße mit unterschiedlichen Krankheitsaspekten korrelierten. DNAmPhenoAge war besonders effektiv darin, das Fortschreiten klinischer Symptome und den kognitiven Abbau zu prognostizieren. Dies wurde unabhängig vom tatsächlichen Lebensalter festgestellt, was bedeutet, dass das biologische Alter mehr über das Krankheitsrisiko aussagt als das bloße Alter in Jahren. DNAmGrimAge hingegen korrelierte stärker mit bildgebenden Biomarkern im Gehirn, die den Krankheitsverlauf widerspiegeln, wie zum Beispiel dem Schwund der Großhirnrinde in Bereichen, die für Gedächtnis und kognitive Funktionen entscheidend sind.
Die Bedeutung neuroimaging-basierter Biomarker wird in der Alzheimer-Forschung immer deutlicher. In der besprochenen Studie wurde umfangreiches MRI-Material ausgewertet, darunter Messungen der kortikalen Dicke in mehreren hunderten Hirnregionen sowie das Ausmaß weißer Substanzveränderungen, sogenannte white matter hyperintensities (WMH), die oft als Marker für vaskuläre Schäden und neurodegenerative Prozesse gelten. Epigenetische Alterung korrelierte mit einer Ausdünnung der Großhirnrinde in AD-relevanten Arealen, darunter der entorhinale Kortex und Bereiche im Parietallappen, die früh im Krankheitsprozess betroffen sind. Gleichzeitig war das epigenetische Alter mit der Ausdehnung von WMH assoziiert, speziell bei Alzheimer-Patienten. Diese Befunde unterstreichen, wie das biologische Alter, das über epigenetische Veränderungen erfasst wird, eng mit den pathologischen Prozessen verbunden ist, die Alzheimer zugrunde liegen.
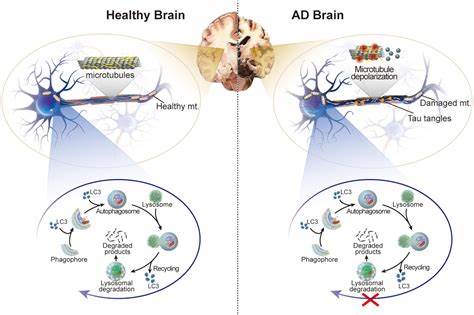
Dabei scheint das epigenetische Alter besonders früh im Krankheitsverlauf eine Rolle zu spielen – noch bevor ausgeprägte klinische Symptome manifest werden. Dies eröffnet neue Perspektiven für den Einsatz dieser Biomarker in der Prävention und in der klinischen Praxis. Traditionelle Diagnose- und Risikobewertungsmethoden für Alzheimer beruhen oft auf bildgebenden Verfahren wie PET-Scans zur Darstellung von Amyloid- und Tau-Proteinablagerungen oder auf invasiven Untersuchungen wie Liquoranalysen. Diese Verfahren sind kostspielig und nicht für jeden Patienten leicht zugänglich. Die Möglichkeit, über eine einfache Blutprobe und die Analyse der DNA-Methylierung das individuelle biologische Alter zu bestimmen und damit Rückschlüsse auf das Alzheimer-Risiko zu schließen, könnte daher die Routinevorsorge revolutionieren.
Die untersuchten epigenetischen Uhren sind keine direkten Abbildungen des chronologischen Alters, vielmehr spiegeln sie komplexe biologische Prozesse wider, die durch Gen-Umwelt-Interaktionen, Entzündungszustände, Stoffwechselerkrankungen und weitere Faktoren beeinflusst werden. So erklärt sich auch, warum Menschen gleichen Alters unterschiedlich stark von neurodegenerativen Erkrankungen betroffen sein können. Ein fortgeschrittenes biologisches Alter signalisiert möglicherweise eine höhere Vulnerabilität gegenüber AD-Pathologien. In der Praxis könnten Ärzte in Zukunft mithilfe des epigenetischen Alters Risikoprofile für ihre Patienten erstellen und gezielt Präventionsmaßnahmen einleiten – etwa eine engmaschigere Überwachung, Anpassung des Lebensstils oder die frühzeitige Einleitung therapeutischer Interventionen. Gerade wegen der langen präsymptomatischen Phase von Alzheimer ist die rechtzeitige Identifikation von Risikopatienten ein entscheidender Schritt, um die Auswirkungen der Erkrankung zu mindern.
Allerdings gibt es noch offene Fragen und Herausforderungen. Die Methode basiert auf Blutproben, was zwar praktisch ist, jedoch stellt sich die Frage, inwiefern diese epigenetischen Veränderungen auch tatsächlich die Vorgänge im Gehirn widerspiegeln. Aktuelle Studien belegen jedoch eine gute Übereinstimmung zwischen Blut- und Hirn-Methylierungsprofilen, was die Aussagekraft dieser Biomarker stärkt. Dennoch sind weitere Forschungen notwendig, um die Mechanismen besser zu verstehen und die methodische Robustheit zu sichern. Darüber hinaus existieren verschiedene epigenetische Uhren mit teils unterschiedlichem Fokus.
DNAmPhenoAge wurde beispielsweise auf mehrere altersassoziierte klinische Phänotypen trainiert und stellt die allgemeine biologische Alterung dar, während DNAmGrimAge stark mit Mortalitätsrisiken und lebensstilbedingten Faktoren wie Rauchen korreliert. Dies kann die unterschiedlichen Assoziationen mit klinischen und bildgebenden Merkmalen erklären, stellt aber auch die Herausforderung, die jeweils passendste Uhr für Alzheimer-untersuchungen auszuwählen. Die Verbindung von epigenetischer Alterung mit kognitiver Verschlechterung und neurodegenerativen Biomarkern schlägt zudem eine Brücke zwischen molekularbiologischen Prozessen, klinischem Verlauf und strukturellen Veränderungen im Gehirn. Dies könnte helfen, multifaktorielle Pathomechanismen besser zu verstehen und den Einfluss von Umwelt- und Lebensstilfaktoren auf die Alzheimer-Entwicklung zu quantifizieren. Langfristig könnten Kombinationen aus epigenetischer Alterung, genetischen Risikomarkern wie APOE ε4, flüssigen Biomarkern und neuroimaging eine hochpräzise Risikoprognose ermöglichen, die personalisierte Prävention und Therapie erleichtert.
Noch ist die Forschung jedoch in vollem Gang, um die diagnostische und prognostische Genauigkeit weiter zu verbessern. Zusammenfassend zeigt die Untersuchung des epigenetischen Alters anhand von DNA-Methylierung im peripheren Blut großes Potenzial in der Alzheimer-Forschung. Diese Biomarker können vorhersagen, welche Menschen mit kognitiv normalem Status im Laufe der Zeit eine leichte kognitive Beeinträchtigung oder Alzheimer entwickeln. Darüber hinaus korrelieren sie mit messbaren Veränderungen in der Hirnstruktur und der weißen Substanz, die für die Erkrankung relevant sind. Diese Erkenntnisse eröffnen neue Perspektiven für frühzeitige Diagnosen, weniger invasive Testverfahren und personalisierte Medizinansätze.
Sie tragen dazu bei, das Verständnis über das komplexe Zusammenspiel von biologischem Altern und neurodegenerativen Erkrankungen zu vertiefen und näher an nachhaltige Lösungsansätze heranzukommen, die Leben verlängern und die Lebensqualität vieler Betroffener verbessern können.