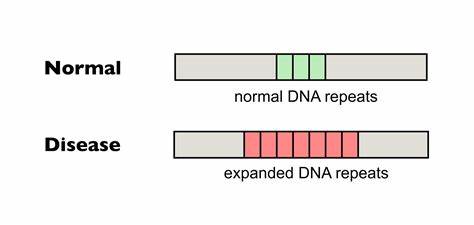
Die Huntington-Krankheit (HD) gehört zu den sogenannten trinukleotid-Repeat-Erkrankungen und stellt aufgrund ihrer genetischen Komplexität eine besondere Herausforderung für die medizinische Forschung dar. Diese neurodegenerative Erkrankung wird durch eine pathologische Expansion von CAG-Trinukleotidsequenzen im HTT-Gen ausgelöst, was in der Bildung toxischer Polyglutamin-Produkte und letztlich zum fortschreitenden Verlust von Nervenzellen führt. Die Länge und Stabilität dieser CAG-Repeats im Genom bestimmen maßgeblich den Zeitpunkt des Krankheitsausbruchs und die Geschwindigkeit der Progression. Eine bahnbrechende Entwicklung im Bereich der Gentherapie und Genom-Editierung eröffnet nun neue Türen: die gezielte Bearbeitung und Unterbrechung dieser repetitiven Sequenzen mit Baseneditoren, um somatische Wiederholungsexpansionen zu reduzieren und so die Krankheitsentwicklung zu bremsen oder gar zu stoppen. Somatische Repeat-Expansionen und ihre Bedeutung bei Huntington Im Gegensatz zur stabilen genetischen Ausstattung in Keimzelllinien sind trinukleotidiale Wiederholungen wie CAG-Sequenzen in den somatischen Zellen vieler Betroffener instabil und können im Laufe des Lebens weiter expandieren.
Diese Expansionen entstehen durch komplexe molekulare Mechanismen, die insbesondere Fehler bei der DNA-Replikation und -Reparatur umfassen und werden durch die Bildung ungewöhnlicher DNA-Strukturen wie Haarnadel- oder Triple-Helix-Formen begünstigt. Längere und unveränderte Repeats erhöhen die Instabilität und fördern die Expansion in Geweben des zentralen Nervensystems, die unmittelbar von neurodegenerativen Schäden betroffen sind. Neuere Forschungsarbeiten zeigen, dass somatische Repeat-Expansionen in neuronalem Gewebe Jahrzehnte vor dem klinischen Ausbruch stattfinden und entscheidend zum Fortschreiten der Erkrankung beitragen. Der Übergang von harmlosen zum pathologischen Zustand hängt sehr stark von der ständigen Zunahme der Repeatlänge ab, was die somatische Instabilität zu einem Schlüsselziel für therapeutische Interventionen macht. Natürliche Unterbrechungen der Repeat-Sequenz als Schutzmechanismus Interessanterweise existieren natürliche Varianten des HTT-Gens, bei denen innerhalb der langen CAG-Repeats sogenannte Unterbrechungen, meist als CAA-Tripletts, eingefügt sind.
Diese Unterbrechungen kodieren zwar für dieselbe Aminosäure Glutamin und führen somit zu einer synonymeren Veränderung, haben aber eine bemerkenswerte Wirkung auf die Stabilität der Wiederholung. Studien belegen, dass solche Unterbrechungen nicht nur die somatische Instabilität reduzieren, sondern auch mit einem deutlich verzögerten Krankheitsbeginn bei Huntington-Patienten assoziiert sind. Die kürzere Zeit bis zum Ausbruch der Symptome kann dabei um ein Jahrzehnt oder mehr verlängert werden – ein antreibender Befund für die Entwicklung von Verfahren, die diese Unterbrechungen künstlich einführen. Basen-Editing-Technologie: Ein innovativer Ansatz zur Modifikation pathogener Repeatstanz Basen-Editing basiert auf einer präzisen, molekularen Veränderung einzelner Nukleotide in der DNA, ohne dass Doppellangsschnitte oder komplexe Reparaturmechanismen benötigt werden. Im Gegensatz zur klassischen CRISPR-Cas9-Technologie, die spezifische DNA-Schnitte erzeugt, ermöglichen Cytosin- und Adeninbaseneditoren gezielte C→T- und A→G-Änderungen mit einem hohen Maß an Präzision.
Somit lassen sich gezielt Unterbrechungen an kritischen Stellen der Wiederholungstrakte einschleusen, die deren Stabilität erhöhen. Der Vorteil von Baseneditoren ist die hohe Effizienz bei gleichzeitig niedrigem Risiko für unvorhergesehene genetische Veränderungen. Im Kontext der Huntington-Krankheit wurde nun gezeigt, dass diese Technologie effektiv an den längeren pathogenen CAG-Repeats ansetzt und dort CAA-Unterbrechungen erzeugt, die das Gen stabilisieren. Erfolge in Patientenzellen: Nachweis der Effektivität in vitro Experimente mit Patienten-fibroblasten, die bereits die pathogene HTT-Mutation tragen, demonstrierten, dass Baseneditoren erfolgreich die Umwandlung von CAG-Abschnitten zu CAA bewirken können. Nach Zellkultur über mehrere Wochen konnte eine signifikante Reduktion der somatischen Expansion von CAG-Repeats nachgewiesen werden.
Diese mithilfe von electroporierten mRNA-Baseneditoren erzielten Unterbrechungen blieben stabil und führten nicht nur zur Verhinderung neuer Erweiterungen, sondern trugen sogar zur Verkleinerung der Repeat-Länge bei. Diese Befunde sind wegweisend für die Translation dieser Technik in präklinische und klinische Anwendungen. Tierversuche mit Huntington-Modellmäusen bestätigen therapeutisches Potenzial Um die Anwendbarkeit im lebenden Organismus zu prüfen, erfolgte die Auslieferung optimierter Baseneditoren via adenoassoziierter Viren (AAV9) in neonatalen Huntington-Krankheitsmäusen. Die Injektion in die Hirnventrikel führte zu einer effizienten Editierung der HTT-Repeats in relevanten Hirnarealen wie Cortex und Striatum. Untersuchungen über Wochen zeigten eine statistisch signifikante Verringerung der somatischen Expansionen im Vergleich zu Kontrollgruppen, wobei die Bearbeitung vornehmlich zu den gewünschten CAA-Unterbrechungen führte.
Zudem wurde beobachtet, dass die Repeatlänge in behandelten Mäusen tendenziell schrumpfte statt sich auszudehnen, was ein potenzielles Verlangsamen beziehungsweise eine Verbesserung des Krankheitsverlaufs nahelegt. Sicherheit und Spezifität der Therapie: Off-Target-Analysen als zentraler Aspekt Ein wichtiger Aspekt bei der Entwicklung von Genom-Editierungstherapien ist die Präzision und Vermeidung unerwünschter Nebeneffekte. Die ausführlichen Untersuchungen mittels in vitro CIRCLE-seq, Hochdurchsatzsequenzierung und Ganzgenomsequenzierung (WGS) offenbarten, dass die Baseneditoren bei der CAG-Repeat-Editierung überwiegend ihre Zielsequenzen bearbeiten. Obwohl viele vergleichbare Repeatsequenzen im menschlichen Genom existieren, führte das sorgfältige Design des Guides und die Verwendung erweiterter Cas-Varianten (Cas9-NG) zu minimiertem Off-Target-Editing. Zudem resultierten Nebenwirkungen meist in synonymeren Codonänderungen, welche kaum Auswirkungen auf die Proteinfunktion haben, was die Sicherheit dieses Ansatzes zusätzlich untermauert.
Ausblick und Herausforderungen der klinischen Umsetzung Die bisherigen Fortschritte wecken große Hoffnung, jedoch gilt es, weitere Hürden zu überwinden. Zu den wichtigen Fragen gehören die Optimierung der Effektivität und Verteilung des Baseneditors in humanen Geweben, insbesondere in nicht-neuronalen Bereichen, die bei Huntington ebenfalls betroffen sein können. Darüber hinaus ist die langfristige Sicherheit von anhaltender AAV-vermittelter Baseneditor-Expression zu klären, einschließlich möglicher immunologischer Reaktionen oder unerwarteter Langzeiteffekte. Neue Liefermethoden, wie virale sowie nicht-virale Systeme, könnten die Expression zeitlich begrenzen und zielgerichteter gestalten, um Risiken zu minimieren. Nicht zuletzt eröffnen Studien mit verbesserten Tiermodellen, die motorische und kognitive Symptome besser abbilden, sowie erste klinische Studien, umfassende Daten zu Wirksamkeit und Verträglichkeit dieses innovativen Therapieansatzes.
Fazit Die gezielte Basen-Editierung von CAG-Repeatsequenzen beim Huntington-Gen stellt einen revolutionären Schritt in der Suche nach dauerhaften Behandlungen von Huntington-Krankheit dar. Indem somatische Repeat-Expansionen in patienteneigenen Zellen und Tiermodellen erfolgreich reduziert werden können, adressiert diese Technik direkt den motorischen und neuronalen Zerfall der Erkrankung. Trotz noch bestehender wissenschaftlicher und technischer Herausforderungen scheint die Kombination aus genomischer Präzision, hoher Spezifität und nachhaltiger Wirkung das Potenzial mitzubrigen, einmalige therapeutische Perspektiven nicht nur für Huntington, sondern generell für trinukleotidale Wiederholungserkrankungen zu schaffen. Die kontinuierliche Forschung und Entwicklung in diesem Bereich bleibt daher essenziell, um diesen vielversprechenden Ansatz bis hin zur klinischen Anwendung zu begleiten.