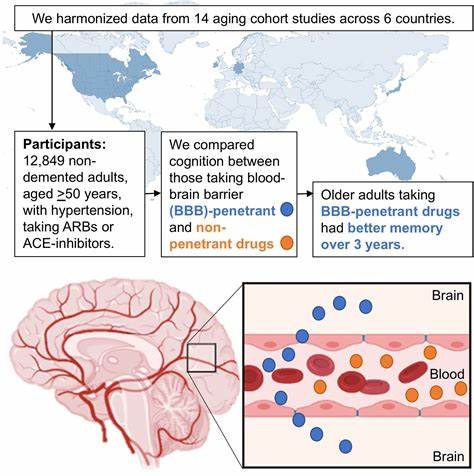
Die Blut-Hirn-Schranke galt lange Zeit als unüberwindbares Hindernis für die Behandlung zahlreicher neurologischer Erkrankungen. Sie schützt das Gehirn vor schädlichen Substanzen im Blut, macht aber gleichzeitig die Einführung von Medikamenten, vor allem größeren biologischen Molekülen, extrem schwierig. Nun bieten neuartige molekulare Transportsysteme Hoffnung auf eine Revolution in der Neuropharmakologie und ermöglichen erstmals, dass wirksame Medikamente direkt ins Gehirn gelangen können. Dies ist ein bedeutender Meilenstein im Kampf gegen Krankheiten wie Alzheimer, Parkinson, seltene genetische Störungen und sogar Hirntumore. Die Entwicklung und präzise Steuerung dieser innovativen Technologien könnten die Zukunft der neurologischen Therapie nachhaltig verändern.
Das Geheimnis und die Herausforderung der Blut-Hirn-Schranke liegen in ihrer außergewöhnlichen Selektivität. Die Barriere besteht aus eng miteinander verbundenen Endothelzellen der Blutgefäße, die nur sehr kleine oder fettlösliche Moleküle durchlassen. Nährstoffe wie Sauerstoff, Glukose oder Eisen gelangen durch spezifische Transportmechanismen ins Gehirn. Größere Moleküle, wie Proteine, Enzyme oder Antikörper, können diese Schranke hingegen kaum passieren. Deshalb sind viele potenziell wirksame Medikamente für neurologische Erkrankungen bislang wirkungslos, weil sie schlicht nicht an ihren Wirkort im Gehirn gelangen.
Der Fall des Hunter-Syndroms verdeutlicht das klinische Potenzial dieser neuen Technologien besonders eindrücklich. Das Hunter-Syndrom ist eine seltene, genetisch bedingte lysosomale Speicherkrankheit, die vor allem Jungen betrifft und durch einen Mangel an einem bestimmten Enzym namens Iduronat-2-Sulfatase (IDS) verursacht wird. Ohne dieses Enzym häufen sich Zellabfallprodukte an, was sowohl körperliche als auch geistige Funktionen stark beeinträchtigt. Traditionelle Behandlungen liefern zwar das fehlende Enzym, es kann jedoch die Blut-Hirn-Schranke nicht überwinden, sodass die Symptome im Gehirn unbehandelt bleiben. Dank neu entwickelter molekularer Transportmechanismen kann das Enzym nun an eine spezielle chemische Markierung gebunden werden, die es ermöglicht, die Blut-Hirn-Schranke zu passieren und genau dorthin zu gelangen, wo es im Gehirn benötigt wird – in die Lysosomen der Nervenzellen.
Die Markierung nutzt den natürlichen Eisen-Transportweg über den Transferrin-Rezeptor aus, der im Endothel der Blutgefäße stark exprimiert ist. Durch diese clevere biologische „Fahrkarte“ gelangt das Enzym ins zentrale Nervensystem und kann dort seine Funktion erfüllen. Erste klinische Studien zeigen vielversprechende Ergebnisse: Kinder mit Hunter-Syndrom weisen Verbesserungen bei Hörvermögen, Bewegung und anderen kognitiven Fähigkeiten auf, die vorher undenkbar schienen. Auch für die Alzheimer-Forschung bedeutet diese Entwicklung einen Paradigmenwechsel. Alzheimer wird unter anderem durch die Ansammlung von Amyloid-Plaques im Gehirn verursacht, die das Gedächtnis und die kognitiven Funktionen stark beeinträchtigen.
Seit einigen Jahren sind Antikörpertherapien zugelassen, die gezielt diese Plaques angreifen. Doch die Wirkung ist durch die Blut-Hirn-Schranke stark eingeschränkt: Nur ein verschwindend kleiner Bruchteil der intravenös verabreichten Antikörper erreicht das Gehirn. Dies erfordert sehr hohe Dosen, die oft Nebenwirkungen nach sich ziehen und kostspielig sind. Die neuen Molekulartransportsysteme versprechen, diesen Wirkverlust zu überwinden, indem sie Antikörper gezielt in das Gehirn bringen. Statt dass die Antikörper nur an den Hirngefäßen agieren, könnten sie so tiefere Hirnregionen erreichen, die besonders von der Erkrankung betroffen sind.
Dies könnte nicht nur die Effektivität der Therapien verbessern, sondern auch die Nebenwirkungen reduzieren und damit die Behandlung insgesamt sicherer und nachhaltiger gestalten. Insbesondere die genaue Kontrolle darüber, wohin im Gehirn das Medikament transportiert wird, ist eine zentrale Forschungsfrage. Jedes neurologische Krankheitsbild erfordert nämlich eine spezifische Verteilung der Wirkstoffe, da unterschiedliche Areale und Zelltypen betroffen sind. Die Kunst besteht darin, eine Kombination aus molekularer Markierung und Medikament zu entwickeln, die gezielt an die richtigen Rezeptoren bindet und somit die gezielte Freisetzung im gewünschten Hirnareal gewährleistet. Die Forschung ist noch in einem frühen Stadium, doch die Fortschritte sind rasant und die Nachfrage in der Pharmaindustrie groß.
Viele führende Unternehmen investieren nun massiv in die Entwicklung solcher „Brain Shuttles“. Die molekulare Technik hinter den „Brain Shuttles“ besticht durch ihre Eleganz. Der Transferrin-Rezeptor, der ursprünglich den Transport von Eisen in das Gehirn sicherstellt, wird durch eine an das Therapeutikum gekoppelte kleine Antikörperregion gezielt angesteuert. Dabei ist es wichtig, dass die Bindung an den Rezeptor weder die normale Funktion des Eisentransports stört noch dazu führt, dass der Rezeptor mit dem Medikament in den Zellen hängenbleibt und abgebaut wird, bevor es ins Gehirngewebe gelangt. Um dies sicherzustellen, haben Forscher in jahrelanger Arbeit die optimale Bindungsstärke und molekulare Struktur optimiert, sodass das Medikament tatsächlich sicher und effizient durch die Endothelzellschichten transportiert wird.
Die Anwendungsmöglichkeiten dieser Innovationen reichen weit über seltene Krankheiten hinaus. Hirntumore, bei denen große molekulare Wirkstoffe wie Antikörper oder genetische Therapien eingesetzt werden, könnten genauso profitieren wie neurodegenerative Erkrankungen verschiedener Art. Die Möglichkeit, eine breite Palette komplexer biologischer Medikamente – von Proteinen über Antikörper bis hin zu viralen Vektoren für Gentherapien – ins Gehirn zu bringen, eröffnet neue therapeutische Strategien, die bisher unmöglich waren. Gleichzeitig werfen diese Fortschritte neue ethische und sicherheitstechnische Fragestellungen auf. Denn mit der Fähigkeit, die Blut-Hirn-Schranke gezielt zu durchdringen, steigt das Risiko möglicher Nebenwirkungen oder ungewollter Immunreaktionen im empfindlichen Hirngewebe.
Daher ist eine sorgfältige Überwachung der klinischen Studien essenziell, um die Verträglichkeit der eingesetzten Transportmechanismen langfristig zu gewährleisten. Zusammenfassend lässt sich sagen, dass die Entwicklung von Technologien zum Transport großer biologischer Wirkstoffe durch die Blut-Hirn-Schranke einen historischen Durchbruch markiert. Sie versprechen, zahlreiche Hirnerkrankungen erstmals effektiv therapieren zu können und bringen Hoffnung für Millionen von Patienten. Die Verbindung aus tiefgreifendem Verständnis der physiologischen Transportmechanismen, präziser Protein- und Antikörpergestaltung sowie klinisch nachgewiesener Wirksamkeit macht diesen Fortschritt zu einem Meilenstein der modernen Medizin. Die kommenden Jahre werden zeigen, wie diese Innovationen weiter ausgebaut, verfeinert und in der klinischen Praxis etabliert werden.
Klar ist jedoch schon heute: Die einst unerreichbare Blut-Hirn-Schranke wird zunehmend durchlässig – und mit ihr eröffnen sich völlig neue Horizonte der medizinischen Behandlung für zahlreiche bisher unheilbare Gehirnerkrankungen.