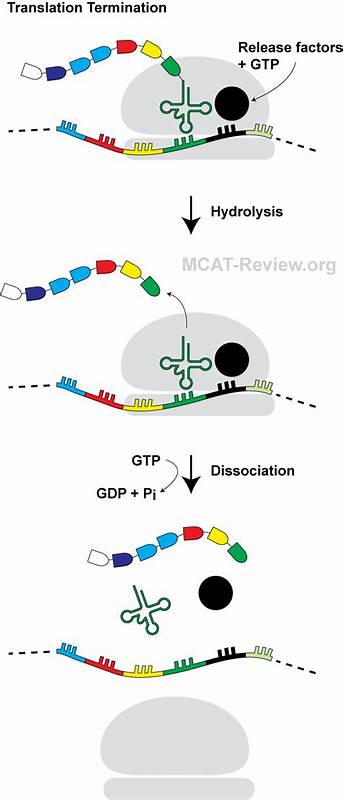
Die Translation, der Prozess der Proteinsynthese im Ribosom, ist ein fundamentaler Schritt der Genexpression in allen Lebewesen. Sie wandelt genetische Informationen aus der mRNA in funktionelle Proteine um, die die vielfältigen zellulären Funktionen ermöglichen. In Bakterien wie Escherichia coli endet die Translation mit dem Erkennen eines Stop-Codons durch Freisetzungsfaktoren (Release Factors), die den Abbau der Peptid-tRNA-Bindung im Peptidyl-Transferase-Zentrum (PTC) katalysieren, was eine Freisetzung des fertigen Proteins bewirkt und die Translation beendet. Dennoch ist seit einiger Zeit bekannt, dass bestimmte naszierende Peptide, also neu entstehende kurze Aminosäureketten im Ribosom, die Translation beeinflussen und manchmal sogar zum Stillstand bringen können. Diese sogenannten Ribosomenarrestpeptide (RAPs) modulieren oft die Genexpression über die Interaktion mit der Ribosomenstruktur im sogenannten naszierenden Peptid-Austrittstunnel (NPET).
Trotz diverser Studien waren die Mechanismen hinter dem Stillstand der Translation durch diese Peptide bisher nur teilweise verstanden. Eine wegweisende Studie, veröffentlicht im renommierten Journal Nature Communications im März 2025, hat nun die Wirkung eines einzigartigen Mini-Haarnadel-Peptids, genannt PepNL, aufgedeckt und zeigt, wie es die Translationsterminierung auf eine bisher unbekannte Weise blockiert. PepNL ist ein nur 14 Aminosäuren langes Peptid, das in E. coli codiert ist. Mittels moderner Techniken wie Ribosomenprofiling, Massenspektrometrie und Kryo-Elektronenmikroskopie (cryo-EM) wurde entdeckt, dass PepNL am Stop-Codon der mRNA zu einem funktionellen Ribosomenstillstand führt.
Während herkömmliche RAPs oft durch spezifische Umweltfaktoren oder Metabolite aktiviert werden, weist PepNL bemerkenswerterweise keine solche Abhängigkeit auf. Es genügt allein die Sequenz des Peptids, das sich innerhalb des Ribosomenkanals auf eine bestimmte Weise faltet und so die Beendigung der Translation hemmt. Die cryo-EM-Strukturanalyse zeigte ein faszinierendes Bild: Statt traditionell vom Peptid-Austrittstunnel weg zu zeigen, faltet sich die N-terminale Region von PepNL zurück zum Eingang des Tunnels. Dieses „Mini-Haarnadel“-Strukturmotiv stabilisiert sich durch intramolekulare Wechselwirkungen wie hydrophobe Kontakte und β-Faltblatt-ähnliche Strukturen. Darüber hinaus erfolgt eine Wechselwirkung mit spezifischen Nukleotiden der 23S rRNA, die die Position des Peptids weiter fixiert.
Im Detail verzerrt diese Konformation die Positionierung des Peptids nahe dem Peptidyl-Transferase-Zentrum, sodass die entscheidende GGQ-Motiv-Schleife des Freisetzungsfaktors RF2 nicht richtig im PTC platziert werden kann. Dieses GGQ-Motiv ist notwendig für die katalytische Spaltung der Peptid-tRNA-Bindung und somit für die Freisetzung des Polypeptids. Die sterische Kollision zwischen einer Isoleucin-Seitenkette am C-Terminus von PepNL und der Gln252-Position der GGQ-Schleife des RF2 verhindert diese essenzielle Interaktion. Dieser Mechanismus unterscheidet sich von anderen bekannten RAPs wie etwa TnaC, die eine Umweltkomponente als Auslöser benötigen. Interessanterweise wirkt PepNL so strikt, dass es die Translation nicht nur an der Terminationsstelle blockiert, sondern auch nachfolgende Schritte wie die Stop-Codon-Überschreitung (read-through) beeinflusst.
Eine hohe Konzentration von Tryptophan und das Vorhandensein von Trp-tRNA^Trp ermöglicht es, das UGA-Stopcodon von PepNL zu lesen und somit die Arrestwirkung abzuschwächen. Dadurch besteht eine Art regulierender Mechanismus, bei dem eine metabolisch bedingte Überschreitung der Stopcodons eine Aufhebung der Arrestsituation bewirken kann. Dies ist eine elegante Form der Regulation, die an die zelluläre Aminosäureverfügbarkeit gekoppelt ist. Die Bedeutung dieser Entdeckung reicht weit über den individuellen Fall von PepNL hinaus. Zum einen zeigt sie, dass Peptid-Strukturen im Naszierenden Kanal weit komplexere Rollen spielen können, als lediglich den Weg der entstehenden Polypeptide zu ebnen.
Ein Mini-Haarnadel-artiger Peptid-Faltmechanismus kann beispielsweise die Translation durch physikalische und sterische Hemmung gezielt steuern. Dies unterstreicht das hochgradig regulierte Zusammenspiel zwischen Peptidsequenz und Ribosomenstruktur. Zum anderen bringt die Studie neue Erkenntnisse zur Feinabstimmung der Translationsterminierung. Die GGQ-Motiv-Region der Freisetzungsfaktoren fungiert nicht nur als einfacher Enzymfaktor, sondern als Sensor für kontextuelle Peptid-Strukturen. Wenn das Peptid eine ungewohnte Konformation einnimmt, wie bei PepNL, wird die Funktion der Freisetzungsfaktoren gehemmt.
Dies führt zu einer vorübergehenden Blockade der Termination und beeinflusst die Genexpression. Somit können selbst sehr kurze Peptide als effiziente molekulare Schalter fungieren. Der Regulierungsmechanismus über PepNL zeigt zudem, dass Übersetzungsarrest nicht zwangsläufig auf externe Metaboliten angewiesen ist. Stattdessen kann die Translation über die intrinsische Faltungsdynamik des naszierenden Peptids gesteuert werden. Dabei könnte die Zeit, die PepNL zum Falten seines Mini-Haarnadel-Motivs benötigt, eine kritische Rolle spielen.
Vor der Faltung sei es möglich, dass das Ribosom das Stopcodon noch effizient überlesen kann, wonach die Arreststrukturen erst aufgebaut werden und ihre hemmende Wirkung entfalten. Diese zeitliche Dimension eröffnet neue Blickwinkel auf die molekulare Regulation und evolutionäre Anpassungen. Die Entdeckung von PepNL erfolgte durch ein umfassendes Screening unbekannter kleiner Offener Leserahmen (sORFs), die zuvor oft übersehen wurden. Dabei erwies sich die Kombination aus phenotypischer Einschätzung (z. B.
Wachstumshemmung), proteomischen Analysen und peptid-tRNAspezifischer Massenspektrometrie als sehr effektiv. Neben PepNL wurde ein weiterer RAP namens NanCL identifiziert, der ebenfalls Translation an Stop-Codons hemmt. Diese neuen Erkenntnisse erweitern das Repertoire bekannter regulatorischer Elemente in Bakterien und möglicherweise auch in eukaryotischen Organismen. Technologisch gezeigt wurde das hohe Potenzial der Kryo-EM für die Aufklärung von Peptid-Ribosom-Komplexen mit atomarer Auflösung. Nur durch diese Technik war die genügend detaillierte Darstellung der Mini-Haarnadel-Struktur möglich, was die minutiösen molekularen Interaktionen zwischen Peptid, rRNA und Freisetzungsfaktor sichtbar macht.
Solche Einblicke fördern das Verständnis der Grundprinzipien von Translation und deren Regulation auf molekularer Ebene. Zukünftig könnten diese Erkenntnisse nützlich sein für die Entwicklung synthetischer regulatorischer Peptide, die gezielt die Proteinbiosynthese steuern. Insbesondere in der Biotechnologie und Medizin bieten sich Ansätze an, neue Antibiotika oder gentherapeutische Werkzeuge zu entwickeln, die die Translation hemmen oder modulieren. Die Vorstellung, dass ein kleines Peptid mittels Faltungsstruktur die essentiellen mechanistischen Abläufe in der Ribosomenfunktion beeinflusst, erweitert den Horizont möglicher Zielstrukturen deutlich. Gleichzeitig ist es wichtig zu betonen, dass die Rolle von PepNL innerhalb der zellulären Physiologie noch nicht vollständig verstanden ist.
Die Regulation des downstream-liegenden Gene pepN durch Translationsterminierungsarrest des pepNL-ORFs weist auf komplexe Kopplungen hin, deren biologische Bedeutung eine spannende Forschungsfrage darstellt. PepN kodiert eine Aminopeptidase, die in der Zelle beim Abbau von Peptiden eine Rolle spielt. Es wird vermutet, dass die PepNL-vermittelte Translation Arrestfunktion die Expression von PepN an zelluläre Bedürfnisse in Bezug auf Proteinhomöostase und Aminosäurenversorgung koppelt. Abschließend zeigt die Erforschung des Mini-Haarnadel-Peptids PepNL eindrucksvoll, wie komplex und vielseitig die molekulare Kontrolle der Translation ablaufen kann. Naszierende Peptide sind weit mehr als einfache Zwischenprodukte der Proteinbiosynthese.
Ihre spezielle Faltung und Interaktion mit dem Ribosom eröffnen neue Kontrollmechanismen, die bisher unterschätzt wurden. Die einzigartige Art, auf die PepNL die Translationsterminierung blockiert, eröffnet viele neue Wege, um die Regulation der Proteinsynthese besser zu verstehen und in biotechnologische oder therapeutische Anwendungen umzusetzen. Das Verständnis solcher feinen Regelmechanismen ist eine entscheidende Grundlage, um Einblicke in die zelluläre Funktionsweise zu gewinnen, neue Medikamente gegen bakterielle Infektionen zu entwickeln und die synthetische Biologie voranzutreiben. Die Erforschung von PepNL und ähnlichen kleinen regulatorischen Peptiden wird zweifellos die molekulare Biologie der Translation in den kommenden Jahren wesentlich prägen und erweitern.