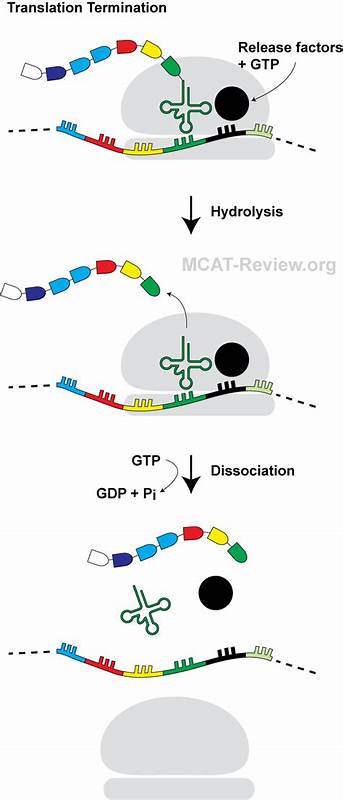
Die Translation ist ein fundamentaler Prozess in der Biologie, bei dem genetische Information aus der mRNA in Proteine übersetzt wird. Ribosomen fungieren dabei als molekulare Fabriken, die Aminosäuren entsprechend der Codons in mRNA verknüpfen. Insbesondere in Bakterien ist die Translation ein hochdynamischer Vorgang, der Start-, Elongations- und Terminationsphasen umfasst. Während der Termination erkennen Freisetzungsfaktoren die Stopp-Codons und katalysieren die Freisetzung des neu synthetisierten Proteins. Das Verständnis der vielfältigen Regulierungsmechanismen in diesem Prozess ist entscheidend, um die Komplexität der Genexpression zu erfassen.
Eine aktuelle wegweisende Studie zeigt, wie ein mini-Haarnadel-Peptid die Translationstermination durch einen bisher unbekannten Mechanismus blockiert und damit tiefere Einblicke in die Funktionsweise der Ribosomen ermöglicht. Der Ausgangspunkt für diese Entdeckung war die Suche nach bisher unverstandenen Peptidsequenzen, die Ribosomen am Fortgang der Translation hindern können. Solche sogenannten Ribosomenarrestpeptide (RAPs) interagieren während der Peptidsynthese mit dem Ribosomenausgangstunnel und können dadurch plötzliche Haltepunkte erzeugen. Diese Haltepunkte dienen nicht nur als natürliche Bremsen der Translation, sondern auch als regulatorische Schalter, die die Expression nachgeschalteter Gene beeinflussen. Während mehrere RAPs bereits beschrieben sind, blieb das Gesamtbild, wie diese Peptide wirken und reguliert werden, unvollständig.
Die neue Untersuchung identifizierte zwei bislang unbekannte RAPs in Escherichia coli, genannt PepNL und NanCL. Diese Peptide sind kurz, bestehen aus nur 14 Aminosäuren und induzieren eine starke Translationsterminationsarrestierung an ihren Stoppsignalen. Durch die Kombination von Phänotypuntersuchungen, Proteom-Analysen und Massenspektrometrie konnte nachgewiesen werden, dass die Expression dieser Peptide das Zellwachstum hemmt und spezifische Stressantworten auslöst. Besonders die Analyse von PepNL mittels Kryo-Elektronenmikroskopie (cryo-EM) eröffnete spektakuläre Einblicke in seine Struktur und Wirkungsweise. Das PepNL-Peptid bildet im Ribosomenausgangstunnel eine ungewöhnliche mini-Haarstruktur, bei der der N-Terminus des Peptids nicht, wie üblich, in Richtung Tunnelende verläuft, sondern zurück zum Eingang des Tunnels gefaltet ist.
Diese kompakte Faltung ermöglicht einen piekfeinen Eingriff in die Funktionsweise des Freisetzungsfaktors RF2, der für die Erkennung des UGA-Stopp-Codons und die Freisetzung der Polypeptidkette zuständig ist. Die Struktur von RF2 beinhaltet ein katalytisches GGQ-Motiv, das in den Peptidyltransferase-Zentrum (PTC) eindringt, um die esterische Bindung zwischen Peptid und tRNA zu hydrolysieren. Das mini-Haarnadel-PepNL bringt jedoch eine Störung in die Raumstruktur des PTC, indem es eine Sterische Kollision zwischen der Isoleucin-Restgruppe im C-terminalen Bereich von PepNL und dem GGQ-Motiv von RF2 verursacht. Diese Kollision führt zu einer Abweichung der RF2-Struktur in eine inaktive Konformation, welche die Termination der Translation effektiv blockiert. Es ist wichtig hervorzuheben, dass diese Form des Translationsterminationsarrests einzigartig ist, da sie ohne den Einfluss zusätzlicher Liganden oder Metaboliten auskommt – im Gegensatz zu bekannten Mechanismen wie beim TnaC-Peptid, das durch hohe Tryptophanspiegel ausgelöst wird.
Vielmehr nutzen PepNL und sein Mechanismus eine intrinsische Faltung innerhalb des Peptids, was es zu einem autonomen Regulator der Translation macht. Interessanterweise offenbart die Studie weitere mechanistische Details: Die Hemmung der Translation durch PepNL kann durch eine Art Stopcodon-Read-through gelindert werden, bei dem Tryptophanyl-tRNA die Erkennung des UGA-Stopps überspringt und die Translation fortsetzt. Dies bedeutet, dass PepNL über einen intrinsischen Schalter verfügt, der durch Verfügbarkeit von Trp-tRNA beeinflusst wird. Sollte der tRNA-Lieferant nicht vorhanden sein, entfaltet sich die Mini-Haarstruktur und blockiert die Termination. Andernfalls erfolgt ein Überspringen des Stopcodons, das die Arrestfunktion abschwächt.
Die cryo-EM-Struktur der PepNL-arrestierten Ribosomen zeigt eine imposante Interaktion des Peptids mit spezifischen Bereichen der 23S rRNA im Tunnel, darunter die Basen U2609, A2062 und die 23S RNA betonte Strukturpunkte A2058 und A2059. Intramolekulare Wechselwirkungen stabilisieren die Mini-Haarstruktur mit hydrophoben Kontakten zwischen den Seitenketten von Isoleucin, Leucin und Tyrosin. Mutationen dieser Schlüsselameinouren verschlechtern den Arrest-Effekt und bestätigen die Bedeutung der Haarnadelfaltung für die Wirksamkeit des Peptids. Auf funktioneller Ebene reguliert die Translation von PepNL die Expression des nachfolgenden Aminopeptidase-Gens pepN in E. coli.
PepN ist für den Abbau verschiedener Peptide und Polypeptide zuständig. Somit könnte die nebenläufige Regulation der Translation durch PepNL eine adaptive Antwort auf Umweltbedingungen ermöglichen, indem das Proteinabbau-System je nach Stoppstellenarrest angepasst wird. Der neu entdeckte Mechanismus erweitert das Verständnis darüber, wie Peptidsequenzen innerhalb des Ribosoms die Translation nicht nur verlangsamen, sondern gezielt anhalten oder modifizieren können. Die Rolle der Nascent Chain als Regulationsfaktor gewinnt zunehmend an Bedeutung, da sie ermöglicht, dass die Proteinsynthese direkt und effizient auf zelluläre Zustände reagiert. Das mini-Haarnadel-Peptid aus der Untersuchung ist ein prägnantes Beispiel, wie selbst kurze Peptidsequenzen komplexe strukturelle Änderungen induzieren und dadurch den Ablauf des Ribosoms beeinflussen können.
Forschungsansätze wie die Kombination aus genetischer Überexpression, Proteomanalyse und fortschrittlicher Strukturbiologie (insbesondere Kryo-Elektronenmikroskopie) erlauben einen tiefgehenden Einblick in die molekularen Mechanismen der Proteinbiosynthese. Die Entdeckung von PepNL und NanCL zeigt auch, dass die bakterielle Translation noch viele verborgene Regulationsebenen birgt, deren Erforschung potenzielle Anwendungen in Biotechnologie, Antibiotika-Design sowie der Kontrolle von Genexpressionsnetzwerken bieten kann. Des Weiteren unterstreicht diese Studie die Bedeutung von naszierenden Peptiden für die zelluläre Selbstregulation und Stressreaktionen. Die Verbindung zwischen Translation Arrest und der Induktion von Kälteschockproteinen zeigt, dass die Zelle auf Störungen im Translationsprozess mit einem umfassenden Stressprogramm reagiert. Dabei könnte die Entdeckung von potenziellen neuen Kontrollpunkten in der Translation auch neue therapeutische Ansatzpunkte eröffnen, besonders angesichts der Vitalität des Ribosoms als Ziel für zahlreiche Antibiotika.
Zukünftige Forschungen werden sich womöglich darauf konzentrieren, wie Peptidstrukturen wie das mini-Haarnadel-Peptid zeitlich und räumlich innerhalb der Ribosomenmoleküle entstehen und wie ihre Ausbildung durch unterschiedliche zelluläre Faktoren beeinflusst wird. Ein besseres Verständnis der Balance zwischen Arrest-Induktion und Stopcodon-Read-through kann weiterführende Erkenntnisse über die dynamische Regulation der Proteinbiosynthese liefern. Zudem kann die Untersuchung anderer ähnlicher kurzer sORF-kodierter Peptide neue Arten der Translationseinschränkung und -modifikation aufdecken. Insgesamt stellt das mini-Haarnadel-Peptid PepNL einen faszinierenden Mechanismus dar, durch den Translationstermination blockiert wird. Seine Fähigkeit, durch eine einzigartige Faltung am Ribosom als molekularer Schalter zu fungieren, zeigt die erstaunliche Vielseitigkeit und Komplexität des genetischen Codes und der Proteinsynthese.
Diese Entdeckung markiert einen bedeutenden Schritt in der molekularen Biologie und öffnet Türen für innovative Ansätze in der Genregulation und therapeutischen Intervention.