Die Therapie neuropsychiatrischer Erkrankungen wie Schizophrenie und Depression stellt die moderne Medizin vor große Herausforderungen. Klassische antipsychotische Medikamente wirken hauptsächlich durch die Blockade dopaminerger Rezeptoren, speziell des Dopamin D2-Rezeptors. Während diese Wirkstoffe positive Symptome wie Halluzinationen und Wahnvorstellungen abmildern können, versagen sie häufig bei den negativen und kognitiven Symptomen der Erkrankung und gehen mit erheblichen Nebenwirkungen einher. In diesem Kontext gewinnt die Erforschung psychedelischer Substanzen, insbesondere ihrer neuroplastischen Potenziale, zunehmend an Bedeutung. Neuester Forschungsfortschritt aus den USA macht Hoffnung auf innovative Therapieansätze ohne die klassischen Nachteile psychedelischer Halluzinogene.
Ein Team von Wissenschaftlern rund um Jeremy R. Tuck und David E. Olson entwickelte eine molekulare Variante von Lysergsäurediethylamid (LSD), die unter dem Namen JRT bekannt ist. Dieses neuartige Analogon unterscheidet sich chemisch lediglich durch die Verschiebung von zwei Atomen in seiner Struktur und besitzt dadurch ein deutlich verändertes Wirkprofil. Trotz der engen Verwandtschaft zu LSD zeigt JRT eine starke Fähigkeit, neuronale Plastizität zu fördern, ohne typische halluzinogene Effekte hervorzurufen.
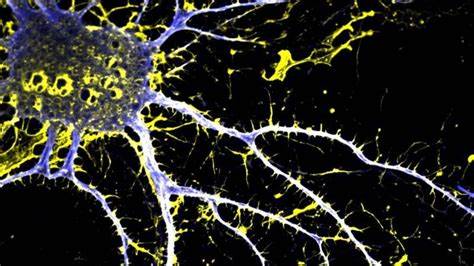
Die Bedeutung von Neuroplastizität, also die Fähigkeit des Gehirns, neue neuronale Verbindungen zu schaffen und bestehende zu stärken, wird gerade im Kontext von Schizophrenie immer klarer. Typisch für die Erkrankung sind verringerte Dichte dendritischer Dornen in den kortikalen Regionen des Gehirns, was unter anderem mit kognitiven und negativen Symptomen assoziiert wird. Psychedelika wie LSD haben sich in experimentellen Studien als starke Induktoren für dendritisches Wachstum erwiesen, weshalb sie als zukunftsträchtige Therapieoption betrachtet werden. Allerdings verbietet die halluzinogene Wirkung vieler dieser Substanzen den Einsatz bei Patienten mit Psychosen oder entsprechenden familiären Risikofaktoren. Hier setzt JRT an: Es erfüllt eine therapeutisch wichtige Lücke, indem es die wachstumsfördernden Eigenschaften von LSD auf neuronaler Ebene beibehält, während die Fähigkeit, Halluzinationen zu erzeugen, stark reduziert ist.
Das entscheidende molekulare Merkmal, das diesen Effekt ermöglicht, ist der Wegfall einer bestimmten Wasserstoffbrückenbindung an den 5-HT2A-Serotoninrezeptoren, die für das Auslösen psychedelischer Erfahrungen essentiell ist. Molekulare Docking-Studien bestätigten, dass JRT innerhalb des Rezeptor-Bindungsdomäns eine sehr ähnliche Position einnimmt wie LSD, jedoch mit einer entscheidenden Distanzveränderung, die mutmaßlich die Signalkaskade so moduliert, dass halluzinogene Effekte nicht ausgelöst werden. Anhand umfangreicher pharmakologischer Experimente wurde die Wirkung von JRT im Vergleich zu LSD und anderen Substanzen untersucht. Bemerkenswert ist, dass JRT keine Affinität zu Dopamin-, Histamin- oder Adrenergenen Rezeptoren zeigt, womit klassische dopaminerge Pathways, die oft mit unerwünschten Nebenwirkungen oder Wirkungsverlusten in Verbindung gebracht werden, ausbleiben. Stattdessen agiert JRT gezielt als partieller Agonist an mehreren Serotoninrezeptoren, insbesondere den 5-HT2A, 5-HT2B und 5-HT2C Subtypen.
Die Aktivierung dieser Rezeptoren ist für neuroplastische Effekte wichtig, wobei der partielle Agonismus an 5-HT2A entscheidend zur Reduktion der halluzinogenen Potentiale beiträgt. In vitro Tests mit neuronalen Kulturen belegen die Fähigkeit von JRT, die dendritische Verzweigung sowie die Dichte der dendritischen Dornen deutlich zu steigern. Im direkten Vergleich war JRT sogar teilweise wirksamer als LSD und der atypische Antipsychotikum Clozapin, wobei Letzterer in den gleichen Experimenten keine wirkliche Förderung dendritischer Verzweigungen erreichen konnte. Die spinogene Wirkung von JRT wurde zudem durch den Einsatz von Antagonisten am 5-HT2-Rezeptor blockiert, was die Rezeptorabhängigkeit unterstreicht. Die Wirksamkeit von JRT wurde bereits in vivo an Mäusen bewertet.
Eine Einzelinjektion führte im medialen präfrontalen Kortex zu einer signifikanten Erhöhung der dendritischen Dornendichte sowie einer Zunahme an Synapsendichte. Unter einem chronischen Stressmodell, das mittels Corticosteron verabreicht wurde und für eine strukturelle Atrophie im Kortex sorgt, konnte eine einzelne Gabe von JRT den Stress-bedingten Verlust dendritischer Dornen weitgehend rückgängig machen. Die Wiederherstellung der neuronalen Struktur könnte die Grundlage für die beobachteten Verbesserungen in diversen Verhaltensassays sein. Klinisch relevante Verhaltensmodelle zeigten, dass JRT im Gegensatz zu LSD kein Halluzinogen-typisches Verhalten auslöste. Der Head-Twitch-Response-Test, ein etablierter Marker für halluzinogene Aktivität bei Mäusen, blieb bei JRT selbst bei hohen Dosen aus.
Interessanterweise wurde der durch LSD induzierte Head-Twitch-Response durch eine Vorbehandlung mit JRT deutlich vermindert, was auf eine mögliche antagonistische Wirkung gegenüber klassischen Halluzinogenen schließen lässt. Darüber hinaus zeigte JRT keine Verschlechterung von Verhaltensparametern, die in Tiermodellen als Indikatoren für positive Symptome der Schizophrenie gelten, darunter Prepulse-Inhibition-Defizite oder Hyperaktivität durch das Dopaminagonist Amphetamin. Tatsächlich konnte JRT die amphetamin-induzierte Hyperbeweglichkeit bei weiblichen Mäusen reduzieren, was trotz fehlender Dopaminrezeptor-Affinität eine antipsychotische Wirksamkeit nahelegt. Eine weitere Ebene der Untersuchung stellte die Genexpressionsanalyse im präfrontalen Kortex dar. Die Anwendung von LSD führte zu einer Dysregulation von Genen, die typischerweise bei Schizophrenie verändert sind.
Dagegen wurde bei JRT keine Überrepräsentanz solcher schizophrenia-relevanten Genexpressionsprofile registriert, was die Sicherheit angesichts möglicher Psychose Auslöser unterstreicht. Neben den positiven Wirkungen auf neuronale Struktur zeigte JRT auch in Verhaltensmodellen depressions- und kognitionsrelevante Vorteile. Im Forced-Swim-Test, der prädiktiv für Antidepressiva ist, erzeugte JRT starke und langanhaltende antidepressiv-ähnliche Effekte bei deutlich geringeren Dosen als das etablierte ketaminbasierte Antidepressivum. In anderen Modellen, die Anhedonie simulieren, konnte JRT die verminderte Belohnungsverarbeitung rückgängig machen und damit negative Symptome psychischer Erkrankungen adressieren. Die kognitive Leistungsfähigkeit wurde ebenfalls positiv beeinflusst.
In einem Reversalleselernen-Test, der kognitive Flexibilität erfasst und der bei Patienten mit Schizophrenie und affektiven Störungen oft beeinträchtigt ist, kehrte eine Einzeldosis JRT die durch Stress induzierten Defizite vollständig um. Diese Effekte stützen die Hypothese, dass JRT nicht nur Symptome lindert, sondern auch funktionelle Hirnnetzwerke wiederherstellt. In der Diskussion wird unterstrichen, dass Behandlungskonzepte für komplexe psychische Erkrankungen ein fein abgestimmtes polypharmakologisches Profil benötigen, um Erfolg zu haben. JRT könnte hier durch seine selektive, serotoninerge Wirkweise mit gleichzeitiger Minimalisierung von Nebenwirkungen und Halluzinationen eine bedeutende Rolle spielen. Besonders der Verzicht auf dopaminerge Modulation vermeidet unerwünschte Bewegungsstörungen und Sedierung, Probleme, die bei vielen aktuellen Antipsychotika bestehen.