Immunantworten auf Impfungen sind komplex und werden von vielen Faktoren beeinflusst, die auf zellulärer und molekularer Ebene miteinander interagieren. Eine der entscheidenden Komponenten des adaptiven Immunsystems, die für den langanhaltenden Schutz vor Krankheitserregern sorgt, sind die Gedächtnis-B-Zellen. Diese Zellen bewahren Informationen über bereits bekannte Antigene und ermöglichen eine schnellere und effektivere Immunreaktion bei erneutem Kontakt mit dem gleichen oder ähnlichen Pathogen. Aktuelle Forschungen haben herausgefunden, dass Makrophagen, speziell die so genannten subkapsulären Sinusmakrophagen (SSMs) in den Lymphknoten, eine Schlüsselrolle bei der ortsabhängigen Reaktivierung von Gedächtnis-B-Zellen spielen. Diese Erkenntnisse eröffnen neue Perspektiven für die Entwicklung von Impfstrategien und das Verständnis dafür, wie der lokale Kontext innerhalb des Immunsystems Einfluss auf die Qualität und Quantität der Antikörperantwort nimmt.
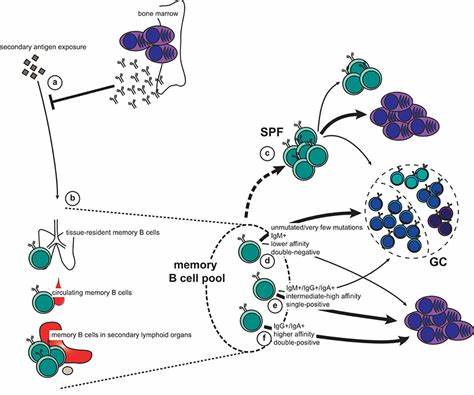
Makrophagen und Gedächtnis-B-Zellen: eine enge Zusammenarbeit im Lymphknoten Makrophagen sind vielseitige Zellen des Immunsystems, die unter anderem als Phagozyten agieren, bei der Antigenpräsentation helfen und das Gewebe in einem immunologischen Gleichgewicht halten. Im Bereich der Lymphknoten befinden sich spezielle Subtypen, die unter anderem als Subkapsuläre Sinusmakrophagen bezeichnet werden. Diese Zellen besetzen die Grenze zwischen dem Lymphtransport und dem lymphatischen Gewebe und spielen eine wichtige Rolle bei der Aufnahme und Präsentation von Antigenen, die über die Lymphe in den Knoten gelangen. Gedächtnis-B-Zellen hingegen sind spezialisierte B-Lymphozyten, die nach einer Erstinfektion oder Impfung entstehen. Sie besitzen die Fähigkeit, sich bei einem erneuten Antigenkontakt schnell zu aktivieren, sich zu vermehren und entweder direkt zu antikörperproduzierenden Plasmazellen zu differenzieren oder erneut in Keimzentren einzutreten, um ihre rezeptorspezifische Affinität durch somatische Hypermutation zu verbessern.
Dieses flexible Verhalten ist für eine effektive und angepasste Immunantwort von zentraler Bedeutung. Jüngste experimentelle Studien in Mausmodellen konnten zeigen, dass Gedächtnis-B-Zellen in den Lymphknoten, die das Areal der ursprünglichen Impfung drainieren (sogenannte draining lymph nodes), eine besondere Lokalisation im subkapsulären Sinus einnehmen. Dort sind sie in engem Kontakt mit den SSMs und zeichnen sich durch ein höheres Potential aus, in Keimzentren zurückzukehren und so die Antikörpervielfalt und -affinität im Rahmen einer Booster-Impfung gezielt zu erweitern. Ortsabhängige Gedächtnisreaktivierung: Warum der Impfort zählt Die Lage des Impfortes beeinflusst maßgeblich die Effizienz der Gedächtnis-B-Zell-Aktivierung. Studien haben gezeigt, dass eine Booster-Impfung, die am gleichen Körperteil wie die Primärimpfung verabreicht wird, also der gleiche Arm oder die gleiche Körperseite, zu einer deutlich stärkeren Recall-Immunantwort führt als eine Impfung auf der gegenüberliegenden Seite.
In den draining lymph nodes der Impfstelle findet eine vermehrte und qualitativ hochwertigere Reaktivierung der Gedächtnis-B-Zellen statt, was sich in einer rascheren Bildung von Keimzentren, einer stärkeren klonalen Expansion und einer größeren Affinitätsreifung der Antikörper niederschlägt. Dieser Effekt ist eng mit der Präsenz und Funktion der subkapsulären Sinusmakrophagen verknüpft. Die SSMs übernehmen die Rolle einer antigenpräsentierenden Zellschicht, die frisch eingetragene Antigene aus der Lymphe aufnimmt und den Gedächtnis-B-Zellen präsentiert. Gedächtnis-B-Zellen in unmittelbarer Nähe zu diesen SSMs verfügen über ein höheres Aktivierungspotential und eine präferierte Ausrichtung auf die Rückkehr in Keimzentren anstatt der direkten Differenzierung zu Plasmazellen. Hingegen zeigen zirkulierende Gedächtnis-B-Zellen in nicht-drainierenden Lymphknoten ein anderes Verhalten: Sie wiederum tendieren dazu, sich schneller in Plasmazellen zu differenzieren, die eine kurzfristige Antikörperantwort vermitteln, während die Beteiligung an Keimzentren geringer ausfällt.
Diese Tatsache hat wichtige Konsequenzen für die Gestaltung von Impfprotokollen, gerade auch im Kontext immer wieder auftretender Varianten von Viren wie SARS-CoV-2. Molekulare Kommunikation zwischen SSMs und Gedächtnis-B-Zellen Auf molekularer Ebene existiert eine komplexe Interaktion zwischen Makrophagen und Gedächtnis-B-Zellen. Ligand-Rezeptor-Analysen mittels moderner Einzelzell-Transcriptomik haben potenzielle Signalketten identifiziert, die die geographische Positionierung und die Differenzierungswege der Gedächtnis-B-Zellen regulieren. Beispielsweise spielen der Migrationsinhibitorfaktor (MIF) auf der Seite der Makrophagen und seine Rezeptoren CD74 und CD44 auf B-Zellen eine Rolle. Weitere Beteiligte sind Adhäsionsmoleküle wie ICAM-1 und dessen Gegenstücke CD11b/CD18, welche in der Zell-Zell-Kommunikation für die Verankerung im subkapsulären Sinus verantwortlich sind.
Diese molekularen Wechselwirkungen unterstützen nicht nur die physische Nähe, sondern beeinflussen auch Signalwege, die die Reaktivierbarkeit und den Zellschicksalsentscheid von Gedächtnis-B-Zellen fördern. Therapeutisch induzierte oder natürliche „Primung“ der Makrophagen Die Makrophagen stellen also eine Art „Gedächtnisstütze“ im Lymphknoten dar, die insbesondere am Impfort durch das erste Antigen geprägt werden. Bemerkenswert ist, dass selbst die Exposition mit einem antigenfremden, irrelevanten Immunogen am nicht-drainierenden Lymphknoten die SSMs so präparieren kann, dass deren Unterstützung für die Gedächtnisreaktivierung deutlich erhöht wird. Dies unterstützt die Erkenntnis, dass die lokale Immunumgebung und die frühere Antigenkontakte der Makrophagen deren Funktion modulieren und somit den Verlauf der Immunantwort bei erneutem Kontakt mit verwandten oder auch unterschiedlichen Antigenen beeinflussen. Menschliche Studien bestätigen tierexperimentelle Befunde Die Konzepte, die in Mausmodellen erkannt wurden, konnten in klinischen Studien mit gesunden, SARS-CoV-2-naiven Erwachsenen bestätigt werden.
Dabei zeigte sich, dass eine Boosterimpfung mit dem BNT162b2 mRNA-Vakzin am gleichen Arm (und damit im gleichen drainierenden Lymphknoten) wie die Erstimpfung zu einer schnelleren und stärkeren Freisetzung breit neutralisierender Antikörper führte. Zudem wiesen die Lymphknoten eine vermehrte Bildung von Keimzentren auf, was die weitere Affinitätsreifung unterstützt. Interessanterweise zeigte sich diese Überlegenheit nur in der frühen Phase nach der Boosterimpfung, wohingegen die Unterschiede zu späteren Zeitpunkten geringer oder kaum messbar waren. Eine modellgestützte Analyse ergab, dass die Geschwindigkeit der Antikörperbildung durch ortsabhängige Aktivierung der Gedächtnis-B-Zellen sowie deren Klonausweitung im selben Lymphknoten gesteigert ist, was zur raschen Erhöhung des Schutzes führt. Dieser Erkenntnis kommt gerade während pandemischer Situationen große Bedeutung zu, da eine frühe breite Immunität eine wesentliche Rolle bei der Eindämmung von Infektionswellen spielen kann.
Auswirkungen auf zukünftige Impfstrategien und Präzisionsimpfungen Die Entdeckung, dass die lokale Immunumgebung und die Makrophagenpopulationen an der Impfstelle maßgeblichen Einfluss auf die Gedächtnisreaktivierung ausüben, wirft ein neues Licht auf die Gestaltung von Impfprogrammen. Insbesondere die Wahl des Impfortes bei aufeinanderfolgenden Impfungen kann die Effizienz der Immunantwort verbessern. Gezielte Strategien, die darauf zielen, die subkapsulären Sinusmakrophagen zu aktivieren oder ihre Interaktion mit Gedächtnis-B-Zellen zu verbessern, könnten künftig dazu beitragen, Impfstoffe effektiver zu machen, vor allem gegen Varianten von schnell mutierenden Viren. Dies schließt die mögliche Entwicklung von Adjuvantien oder Impfstoffformulierungen ein, die eine verstärkte Lokalisierung und Aktivierung in den drainierenden Lymphknoten fördern. Zudem eröffnen diese Daten die Möglichkeit, die Prinzipien der Präzisionsimpfstoffentwicklung umzusetzen, indem individuelle sowie lokale Faktoren stärker berücksichtigt werden, um die Schutzwirkung zu maximieren.
Hierbei sind weitere Studien nötig, die das komplexe Zusammenspiel zwischen verschiedenen Immunzelltypen und der Mikroumgebung abbilden und verstehen helfen. Fazit Die gezielte Reaktivierung von Gedächtnis-B-Zellen nach einer Impfung ist entscheidend für eine effektive und anhaltende Immunität. Makrophagen im subkapsulären Sinus der drainierenden Lymphknoten übernehmen dabei eine zentrale Rolle, indem sie den Ort und die Art der Gedächtnisreaktivierung steuern. Die ortsabhängige Unterstützung durch diese spezialisierten Makrophagen fördert vor allem die Rückkehr von Gedächtnis-B-Zellen in Keimzentren und die Produktion qualitativ hochwertiger Antikörper. Die Erkenntnisse, dass Boosterimpfungen am gleichen Körperteil wie die Primärimpfung verabreicht werden sollten, um eine stärkere und breitere Immunantwort zu erzielen, haben unmittelbare praktische Relevanz.
Gleichzeitig eröffnen sie neue Forschungsfelder zur Manipulation der lokalen Immunumgebung durch gezielte Aktivierung der subkapsulären Sinusmakrophagen. Insgesamt tragen diese Studien entscheidend zum Feld der Präzisionsvakzinologie bei, das zum Ziel hat, Impfungen wirksamer und zielgerichteter zu gestalten und so den Schutz vor Infektionskrankheiten nachhaltig zu verbessern.



![Compiler Considerations in Migrating to OpenVMS on x86 [video]](/images/2DD55340-3D9D-4784-A25A-B29E8BE5C3A1)