Krebs- und Tumorprogression sind komplexe Prozesse, die maßgeblich durch die Fähigkeit der Tumorzellen beeinflusst werden, Nährstoffe in ihrer Umgebung aufzunehmen und zu metabolisieren. Die ständige Suche nach innovativen Therapieansätzen hat Wissenschaftler dazu veranlasst, die Rolle von Adipozyten – den Fettzellen – im Tumormikromilieu neu zu betrachten. Insbesondere die Implantation von genetisch modifizierten Adipozyten, sogenannten „engineered adipocytes“, gewinnt zunehmend an Bedeutung, da sie den Tumorzellen metabolisch Konkurrenz machen und dadurch das Tumorwachstum signifikant hemmen können. Diese neue Methode eröffnet Hoffnung auf wirksame Behandlungsstrategien bei verschiedenen Krebsarten. Ein zentrales Merkmal von Krebszellen ist ihre Fähigkeit, in einem oft hypoxischen und nährstoffarmen Mikromilieu zu überleben und sich zu vermehren.
Dafür passen sich die Krebszellen metabolisch an, indem sie Glukose und Fettsäuren verstärkt aufnehmen und nutzen. Insbesondere der sogenannte Warburg-Effekt, bei dem Krebszellen auch in Gegenwart von Sauerstoff bevorzugt auf Glykolyse zurückgreifen, sorgt für eine hohe Aufnahme von Glukose. Parallel dazu steigt die Lipidnutzung während hypoxischer Bedingungen, da Fettsäuren eine energiereichere Alternative darstellen. Diese metabolische Flexibilität der Tumore macht sie besonders widerstandsfähig und therapeutisch herausfordernd. An dem innovativen Konzept, das als adipose manipulation transplantation (AMT) bezeichnet wird, wurde intensiv geforscht.
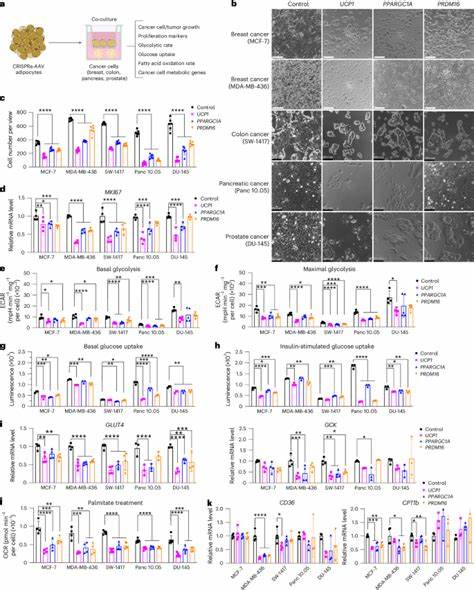
Das Verfahren basiert auf der Entnahme von weißem Fettgewebe, das dann im Labor genetisch so modifiziert wird, dass es eine gesteigerte Aufnahme und Verstoffwechslung von Glukose und Fettsäuren zeigt. Insbesondere durch die CRISPR-aktivierte Hochregulierung des Gens UCP1, das normalerweise in braunem Fettgewebe (BAT) vorkommt, erhalten die Adipozyten eine braune oder beige Fettzellcharakteristik. Diese „braungewordenen“ Adipozyten verbrauchen mehr Nährstoffe und setzen Energie in Form von Wärme frei – ein Prozess, der sowohl den Energieverbrauch steigert als auch die Verfügbarkeit von Nährstoffen für Tumorzellen erheblich reduziert. Im Rahmen vielfältiger In-vitro- und In-vivo-Studien konnten Forscher demonstrieren, dass die Ko-Kultivierung von mit UCP1 oder anderen BAT-Regulatoren modifizierten Adipozyten mit verschiedenen Krebszelllinien – darunter Brust-, Darm-, Pankreas- sowie Prostatakrebs – zu einer signifikanten Reduktion des Tumorwachstums führt. Dabei zeigte sich, dass Krebszellen deutlich weniger proliferieren, was mit einer verringerten Expression von Proliferationsmarkern wie MKI67 einherging.
Die modifizierten Fettzellen konnten die Glukoseaufnahme und die Fettsäureoxidation der Tumorzellen vermindern, was darauf hindeutet, dass der Konkurrenzkampf um Nährstoffe ein zentrale Mechanismus der Tumorsuppression ist. Darüber hinaus wurde die Wirksamkeit dieser Technik in Tiermodellen bestätigt. In xenotransplantierten Mäusen, in denen menschliche Tumorzellen zusammen mit genetisch modifizierten Adipozyten implantiert wurden, reduzierte sich das Tumorvolumen um mehr als die Hälfte im Vergleich zu Kontrollgruppen. Interessanterweise kam es auch zu einer verbesserten Mikrogefäßdichte und einer Verringerung der Hypoxie im Tumorgewebe, was auf eine nachhaltige Veränderung des Tumormikromilieus schließen lässt. Zudem wurden erhöhte Apoptoseraten in Tumoren beobachtet, was auf das vermehrte Absterben von Krebszellen hindeutet.
Ein besonders innovativer Aspekt dieser Methodik ist die Möglichkeit, die Implantation sowohl lokal direkt neben dem Tumor als auch distal – fernab vom primären Tumorherd – vorzunehmen. Dies ist für potenzielle klinische Anwendungen von großem Vorteil, da die modifizierten Adipozyten auch systemische Effekte erzielen können. Dies spiegelt sich darin wider, dass implantierte „braune“ Adipozyten den gesamten Glukosestoffwechsel des Organismus beeinflussen, die Insulinempfindlichkeit verbessern und die Plasmaspiegel von Insulin senken. Da Insulin ein starker Wachstumsfaktor für viele Tumore ist, ergänzt dieser Mechanismus die direkte metabolische Konkurrenz und verstärkt die tumorhemmende Wirkung. Auch die Anpassung der Therapie an verschiedene Tumorprofile wurde erfolgreich gezeigt.
So können adipöse Organoide durch Hochregulierung spezifischer Gene wie UPP1 geschaffen werden, welche den Stoffwechselweg von Uridin, einer zentralen metabolischen Komponente bestimmter Pankreaskarzinome, beeinflussen. Auf diese Weise lässt sich die Therapie gezielt an die metabolischen Bedürfnisse unterschiedlicher Tumorarten anpassen, was eine personalisierte Medizin verspricht. Die Anwendung von CRISPRa zur Modulation der Adipozytenfunktionen bietet einige Vorteile gegenüber herkömmlichen Methoden. Durch die Aktivierung der endogenen Gene bleiben die physiologischen Regulationsmechanismen erhalten, was eine kontrollierte Expression erlaubt, die weniger Nebenwirkungen verursacht. Zudem ist die Steuerung der Genexpression mit induzierbaren Systemen wie Tet-On-Medikamenten möglich, sodass die Aktivität der implantierten Adipozyten bei Bedarf ein- und ausgeschaltet werden kann.
Diese Flexibilität ist in klinischen Situationen von hoher Bedeutung, vor allem im Hinblick auf Nebenwirkungen und Tumorheterogenität. Ein weiteres wichtiges Element für die klinische Umsetzung ist die Entwicklung von Zell-Scaffold-Implantationssystemen. Diese fortschrittlichen Trägersysteme bestehen aus biokompatiblen und biologisch abbaubaren Materialien, die eine stabile Verankerung der adipösen Organoide erlauben und eine nachhaltige Integration in das Gewebe fördern. Gleichzeitig bieten sie den Vorteil, dass sie nach Bedarf herausgenommen oder erneuert werden können, was den sicheren Einsatz und eine adaptive Therapie erleichtert. Die Methode der Adipozyten-Implantation als Krebstherapie ist darüber hinaus mit bereits etablierten klinischen Verfahren kompatibel.
Fettgewebe kann unkompliziert mittels Liposuktion entnommen, im Labor modifiziert und anschließend wieder implantiert werden, beispielsweise im Rahmen plastisch-ästhetischer oder rekonstruktiver Chirurgie. Gerade bei Brustkrebspatientinnen, die oft eine Mastektomie mit anschließender Eigengewebe-Rekonstruktion erhalten, kann diese Therapieform nahtlos integriert und patientenspezifisch angepasst werden. Trotz des vielversprechenden Ansatzes sind weitere Forschungen notwendig, um das Langzeitverhalten der implantierten modifizierten Adipozyten zu verstehen. Insbesondere muss das potenzielle Risiko einer cancer-associated cachexia, also eines durch Tumorwachstum bedingten erheblichen Gewichtsverlusts, näher untersucht werden. Die Möglichkeit, die Genexpression mittels Medikamenten gezielt regulieren zu können, sowie die Option, die Implantate zu entfernen, bieten jedoch Sicherheitsmechanismen, die negative Auswirkungen minimieren können.
Zusammenfassend stellt die Implantation von genetisch modifizierten Adipozyten eine hoch innovative und vielversprechende Therapiemöglichkeit dar. Durch die metabolische Konkurrenz der Fettzellen gegen Krebszellen wird ein zentrales Stoffwechselmerkmal von Tumoren effektiv adressiert, was zu einer signifikanten Hemmung des Tumorwachstums führt. Die Flexibilität dieser Technik, ihre Verträglichkeit und die Kompatibilität mit bestehenden klinischen Verfahren positionieren die adipose manipulation transplantation als möglichen Meilenstein in der personalisierten Onkologie und eröffnen neue Perspektiven für zahlreiche Krebsarten. Mit der Weiterentwicklung solcher zellbasierten Therapien, die auf den spezifischen biologischen Mechanismen der Tumore basieren, rückt die Vision einer individuell angepassten, nebenwirkungsarmen Krebsbehandlung in greifbare Nähe. Die Kombination der Adipozytenimplantation mit weiteren Therapieformen könnte synergistische Effekte bewirken und die Erfolgsraten deutlich steigern.
Bereits heute legen die vielversprechenden präklinischen Daten nahe, dass die AMT-Technologie bald den Weg in klinische Studien finden wird, um ihr Potenzial auch bei Patientinnen und Patienten zu testen und die Zukunft der Krebsbehandlung nachhaltig zu verändern.




![The All-New Whoop Experience [video]](/images/FDE973EC-17BB-42C5-84D2-FC70DE785274)