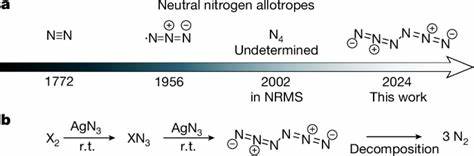
Stickstoff ist als Hauptbestandteil der Erdatmosphäre zwar allgegenwärtig, doch die Vielfalt seiner molekularen Formen ist bislang stark begrenzt. Der stabile, zweiatomige Stickstoff (N2) dominiert die Natur, während höheratomige neutrale Stickstoffallotrope lange Zeit als nahezu unerreichbar galten. Die Vorstellung, noch komplexere molekulare Formen von reinem Stickstoff zu isolieren, stellt die Chemie vor große Herausforderungen. Die erst kürzlich gemeldete Synthese des neutralen Hexanitrogens mit der Summenformel C2h-N6 markiert einen bedeutenden Meilenstein im Bereich der polynitrogenen Verbindungen und eröffnet spannende Möglichkeiten in der Grundlagenforschung sowie für Anwendungen in der Hochenergetik und Energiespeicherung. Die Motivation hinter der Erforschung neutraler Polystickstoff-Verbindungen beruht auf ihrer potenziell enormen Energiedichte.
Im Vergleich zu häufig genutzten Trägern wie Wasserstoff, Ammoniak oder Hydrazin besitzen polynitrogene Moleküle einen deutlich höheren Energiegehalt und zerfallen bei der Zersetzung ausschließlich zu ungefährlichem molekularem Stickstoff. Das ist nicht nur ökologisch vorteilhaft, sondern bietet auch Chancen für vielseitige Energietechnologien mit geringer Umweltbelastung. Allerdings verhindern bisherige Syntheseversuche meist die Isolierung stabiler neutraler polynitrogener Moleküle, da die instabilen Bindungen und geringe Zerfallsbarrieren im Regelfall zu schneller Zersetzung führen. Die erstmalige, erfolgreiche Vorbereitung von Hexanitrogen C2h-N6 wurde durch eine sorgfältig entwickelte Synthesemethode realisiert, bei der Silberazid (AgN3) mit elementarem Chlor (Cl2) oder Brom (Br2) in der Gasphase umgesetzt wird. Die Reaktion findet bei Raumtemperatur unter reduziertem Druck statt.
Die entstehenden Reaktionsprodukte werden anschließend in einer Matrix aus Argongas bei extrem niedrigen Temperaturen von 10 Kelvin eingefroren, um die fragilen Moleküle zu stabilisieren und deren Untersuchung mittels spektroskopischer Methoden zu ermöglichen. Alternativ kann das reine N6 als dünner Film bei flüssigem Stickstoff (77 Kelvin) präpariert werden, was dessen stabile Existenz unter diesen Bedingungen dokumentiert. Das außergewöhnliche an der Synthese des C2h-N6 liegt nicht nur in der Realisierung eines neutralen sechsatomigen Stickstoffmoleküls, sondern auch in der Beobachtung überraschender kinetischer Stabilität. Die Spektroskopie mittels Infrarot- und UV-Vis-Methoden zusammen mit ^15N-Isotopenmarkierungen bestätigen eindeutig die Existenz und Struktur des neuartigen Moleküls. Die experimentellen Ergebnisse korrelieren hervorragend mit hochpräzisen quantenchemischen Rechnungen, die die Molekülgeometrie, Bindungsverhältnisse und energetischen Eigenschaften beschreiben.
Chemisch betrachtet verfügt Hexanitrogen C2h-N6 über eine acyclische Struktur, bestehend aus zwei verbundenen azidischen N3-Einheiten. Die charakteristischen Bindungslängen und Bindungsordnungen weisen auf eine komplexe elektronische Verteilung hin, bei der die Außennitrogene neutral geladen sind, während die inneren Atome aufgrund ihrer Bindungsumgebung leichte partielle Ladungen tragen. Diese Verteilung bedingt die bemerkenswerte Stabilität und die hohe Aktivierungsenergie für die Zersetzung in molekulare N2-Einheiten, deren Freisetzung enorme Energiemengen verspricht. Die theoretischen Analysen mit Methoden wie der Dichtefunktionaltheorie (DFT) und der Coupled-Cluster-Technik (CCSD(T)) ermitteln eine Zersetzungsbarriere von ungefähr 14,8 kcal/mol für den Zerfall von N6 zu drei Molekülen N2. Diese Barriere ist verglichen mit anderen neutralen polynitrogenen Strukturen bemerkenswert hoch, was die Möglichkeit einer praktischen Anwendung unterstützt.
Zwischenschritte wie eine mögliche Aufspaltung in zwei Radikale (•N3) sind energetisch ungünstig und daher unbedeutend für den Zerfallspfad. Darüber hinaus verhindern quantenmechanische Effekte wie der Quantentunneleffekt, die bei vergleichbaren Molekülen zum schnellen Zerfall führen können, die Instabilität von C2h-N6 signifikant. Detaillierte Rechnungen deuten auf eine Halbwertszeit im Millisekundenbereich bei Raumtemperatur und sogar auf Jahre bei tiefen Temperaturen hin. Das bedeutet, dass das Molekül lange genug existiert, um erfasst und weiter untersucht zu werden. Die energetischen Kennzahlen von Hexanitrogen sind beeindruckend.
Die bei thermischer Zerlegung freigesetzte Energie liegt bei mehr als 185 kcal/mol, was die des bekannten Explosivs TNT bei weitem übertrifft. Tatsächlich besitzt C2h-N6 eine etwa zweifach höhere Energiedichte als TNT und übertrifft sogar Hochleistungsexplosive wie HMX oder RDX in Bezug auf Energie pro Gewichtseinheit. Anschließend berechnete Detonationsparameter demonstrieren ebenfalls hohe Werte von Detonationsgeschwindigkeit und Druck, was das Molekül als vielversprechenden Kandidaten für Hochenergieanwendungen qualifiziert. Neben dem energetischen Potenzial eröffnet die Synthese von Hexanitrogen neue Wissenschaftszweige. Die Möglichkeit, neutrale polynitrogene Moleküle jenseits von N2 herzustellen und zu charakterisieren, ermöglicht fundamental neue Einblicke in die Bindungseigenschaften von Stickstoff und in das Design innovativer Moleküle mit spezifischen Funktionen.
Dies betrifft sowohl die Grundlagenchemie als auch angewandte Forschungsfelder wie die Materialwissenschaft und energetische Werkstoffe. Die Herausforderungen der Synthese bestehen neben der hohen Reaktionsgefährdung von Ausgangsmaterialien wie Silberazid und dem Umgang mit halogenen Gasen vor allem in der Kontrolle der Reaktionsbedingungen und der sicheren Handhabung der Produkte. Die niedrigtemperaturmäßige Matrixisolationstechnologie spielt eine entscheidende Rolle für die Identifikation und Stabilisierung der empfindlichen N6-Moleküle. Fortschritte in der Spektroskopie, insbesondere die Anwendung isotopenmarkierter Moleküle, bieten dabei wertvolle Werkzeugmöglichkeiten für die analytische Charakterisierung. Diese wissenschaftliche Leistung zeugt von der engen Verzahnung moderner experimenteller Techniken und computergestützter Chemie.
Durch die Kombination von präzisen quantenchemischen Berechnungen mit innovativen Laborexperimenten konnte ein Molekül identifiziert werden, dessen Existenz über Jahrzehnte hinweg nur theoretisch vermutet wurde. Die experimentelle Bestätigung stellt einen Paradigmenwechsel in der Chemie des Stickstoffs dar. Die alleinige Verwendung von Neutralverbindungen unterscheidet das Hexanitrogen ferner von bisherigen polynitrogenen Ionen. Während ionische Spezies wie das Pentanitrogenkation (N5+) oder das cyclische Pentazolatanion (cyclo-N5−) bereits in Salzen stabilisiert wurden, ist die Grundlage stabiler neutraler Mehratom-Moleküle des Stickstoffs bislang äußerst rar. Hexanitrogen stellt hier nun ein seltenes Beispiel dar, das auch eine Brücke zwischen Ionenchemie und neutralen Molekülen schlägt.
Für die Zukunft sind vielfältige Perspektiven denkbar. Die Erkenntnisse über die Synthese und Stabilität von neutralem N6 können zur Entwicklung neuer energiegeladener Materialien führen, die umweltfreundlicher und effizienter als bisherige Sprengstoffe oder Treibstoffe sind. Darüber hinaus regen sie die Suche nach noch größeren oder andersartigen neutralen polynitrogenen Strukturen an, deren Synthese und Stabilität bis dato Spekulation waren. Zudem kann das Verständnis der molekularen Bindungsverhältnisse von N6 zur Entwicklung theoretischer Modelle beitragen, welche die Reaktivität und den Zerfall weiterer polynitrogener Verbindungen besser vorhersagen. Dies ist für die Sicherheitsbewertung und die rationelle Gestaltung von Hochenergieverbindungen von großer Bedeutung.
Zusammenfassend lässt sich festhalten, dass die erfolgreiche Herstellung von Hexanitrogen C2h-N6 einen Meilenstein in der Chemie des Stickstoffs darstellt. Die Kombination aus überraschender Stabilität, hoher Energiedichte und der experimentellen Zugänglichkeit neutraler Stickstoff-Allotrope eröffnet neue wissenschaftliche und technologische Horizonte. Diese Entdeckung ebnet den Weg für zukünftige Fortschritte in der Energiematerialforschung und erweitert das chemische Verständnis eines der wichtigsten Elemente der Atmosphäre.