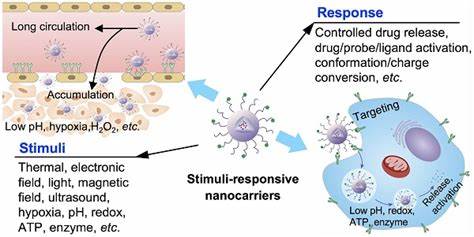
Biofilme stellen in der Medizin eine große Herausforderung dar, da die darin eingebetteten Bakterien gegenüber herkömmlichen Antibiotikatherapien eine erhöhte Toleranz entwickeln. Diese komplexen mikrobiellen Gemeinschaften sind von einer extrazellulären Polysaccharidmatrix umgeben, die als Schutzbarriere wirkt und das Eindringen von antimikrobiellen Substanzen erschwert. Die Folge sind häufig persistente, chronische Infektionen, die mit herkömmlichen Behandlungsmethoden nur schwer kontrollierbar sind und oftmals invasivere Eingriffe oder eine lebenslange Antibiotikatherapie erfordern. Die wachsende Resistenz gegenüber antimikrobiellen Medikamenten verstärkt dieses Problem zusätzlich und unterstreicht die Notwendigkeit innovativer Therapieansätze. Eine vielversprechende Entwicklung in diesem Bereich sind nanoskalige Wirkstoffabgabesysteme, die durch Ultraschall ausgelöst werden können.
Diese Technologie basiert auf sogenannten Nanodroplets – ultrakleinen flüssigen Tröpfchen, die mit antimikrobiellen Wirkstoffen beladen sind und bei gezielter Ultraschallapplikation in mikroskopisch kleine Mikroblasen übergehen. Diese Transformation bewirkt eine mechanische Disruption der schützenden Biofilmstruktur und verbessert gleichzeitig die gezielte Freisetzung und Penetration der Wirkstoffe bis in die bakterielle Zelle hinein. Die Phospholipid-beschichteten Nanodroplets werden mittels eines klinisch zugelassenen Kontrastmittels hergestellt und mit verschiedenen Klassen antimikrobieller Substanzen beladen, darunter Metallkomplexe, Quorum-Sensing-Inhibitoren, Fluorchinolone und antimikrobielle Peptide. Dieses Sortiment ermöglicht ein breit gefächertes Wirkprinzip, das sich gegen unterschiedliche bakterielle Resistenzmechanismen richtet. Die Nanodroplets besitzen eine optimale Größe zwischen 125 und 250 Nanometern, was eine effiziente Penetration in die Biofilmmatrix ermöglicht und gleichzeitig ihre Stabilität sowie Ultraschallreaktivität gewährleistet.
Im laborbasierten Planktonkulturen-Tests mit klinischen Isolaten, darunter multiresistente Staphylococcus aureus und Escherichia coli-Stämme, zeigte sich, dass die in Nanodroplets eingeschlossenen Wirkstoffe in ihrer unaktivierten Form eine gewisse Schutzfunktion auf die Bakterien ausüben, was höhere Konzentrationen für die Hemmung erforderte. Nach Ultraschallapplikation jedoch konnten die Minimalen Bakteriziden Konzentrationen (MBC) signifikant reduziert werden – oft um das mehrere Dutzendfache im Vergleich zur Behandlung mit freien Wirkstoffen. Dies verdeutlicht die Effektivität des Ultraschall-Trigger-Mechanismus, der durch akustische Kavitation nicht nur die Biofilmmasse beeinträchtigt, sondern auch die Aufnahme der Wirkstoffe in die bakteriellen Zellen fördert. Die antibiofilmaktive Wirkung der Nanodroplet- und Ultraschall-Kombination ist besonders bemerkenswert. Biofilme, die sonst eine erhebliche Resistenz gegenüber antibakteriellen Substanzen zeigen, können durch diese Methode gezielt zerstört und deren bakterielle Bewohner effektiv abgetötet werden.
Die erforderlichen Konzentrationen der antimikrobiellen Mittel für die vollständige Biofilmeradikation lagen im Versuch um ein Vielfaches unter denen der herkömmlichen Behandlung. Gleichzeitig wurde gezeigt, dass auch sogenannte Persister-Zellen, eine spezielle Form ruhender, besonders resistente bakterielle Subpopulationen, die für Rückfälle verantwortlich sind, deutlich besser eliminiert werden können. Die Technologie wurde zudem unter simulierten klinischen Bedingungen einer Reihe häufiger Infektionsarten getestet, wie beispielsweise Harnwegsinfektionen, chronische Wunden und Gelenkinfektionen. In diesen Modellen führte die Ultraschall-getriggerte Medikamentenfreisetzung zu einer erheblichen Verringerung der bakteriellen Belastung sowohl in Biofilmen als auch in zellulären Subpopulationen mit vermindertem Stoffwechsel. Insbesondere das Potenzial, biofilminduzierte Zellzerfall und den damit verbundenen Ausbruch von Sekundärinfektionen zu minimieren, stellt einen bedeutenden klinischen Vorteil dar.
Eine weitere zentrale Erkenntnis betrifft die subzelluläre Verteilung der Wirkstoffe. Durch Induktiv gekoppelte Plasma-Massenspektrometrie (ICP-MS) konnte gezeigt werden, dass Nanodroplets die intrazelluläre Aufnahme und die Verteilung der antimikrobiellen Wirkstoffe deutlich verbessern. Während freie Antibiotika häufig im bakteriellen Zellwandbereich verbleiben, gelangen die durch Nanodroplets freigesetzten Wirkstoffe verstärkt bis in membrangebundene Kompartimente sowie in das Cytoplasma, wo sie effektiver agieren können. Diese bessere Verteilung wird vor allem durch die mechanischen Effekte der Ultraschallvaporisation und Kavitation unterstützt, die die Zellmembranen disturbieren und dadurch die Penetration erleichtern. Die Kombination aus selektiver Biofilmdisruption und präziser Wirkstofffreisetzung bietet damit eine effektive Strategie zur Überwindung der bisher limitierenden Barrieren bei der antibakteriellen Therapie von Biofilminfektionen.
Die nachgewiesene Langzeitstabilität und die klinische Nachvollziehbarkeit der eingesetzten Nanodroplet-Konstrukte schaffen zudem eine solide Basis für die spätere Überführung in die therapeutische Praxis. Die Aussicht, bestehende antimikrobielle Wirkstoffe mittels Ultraschall-getriggerten Systemen neu zu nutzen und so die Wirksamkeit deutlich zu steigern, macht diese Technologie besonders attraktiv. Gleichzeitig wird durch die Nutzung etablierter Kontrastmittelkomponenten und klinisch verfügbarer Ultraschallgeräte eine schnelle und sichere Translation möglich, ohne aufwendige Neuentwicklungen von Wirkstoffen und langen Zulassungsprozessen. Das eröffnet neue Perspektiven im Kampf gegen die zunehmende Problematik von antibiotikaresistenten Biofilm-assoziierten Infektionen. Zukünftige Forschungsbereiche können auf die Integration weiterer antibiofilmaktiver Substanzen, etwa enzymatische Matrixabbauer oder bioaktive Gase, abzielen, um die Wirksamkeit und Spezifität weiter zu erhöhen.
Ebenfalls relevant sind Untersuchungen zur Anwendung bei unterschiedlichen Patientenpopulationen und klinischen Szenarien, inklusive komplexer multibakterieller Biofilme. Zusammenfassend lässt sich feststellen, dass ultraschallaktivierte nanoskalige Wirkstoffabgabesysteme eine innovative und vielversprechende Methode darstellen, um die Herausforderungen chronischer Biofilminfektionen zu bewältigen. Die sich daraus ergebenden therapeutischen Vorteile reichen von der Reduktion der benötigten Medikamentendosen über die effektive Entfernung resistenter Bakterien bis hin zur Minimierung von Rückfällen durch Persisterzellen. Angesichts der global steigenden Bedrohung durch antimikrobielle Resistenzen bietet diese Technologie einen wertvollen Ansatz für die Zukunft der Infektionsbehandlung.