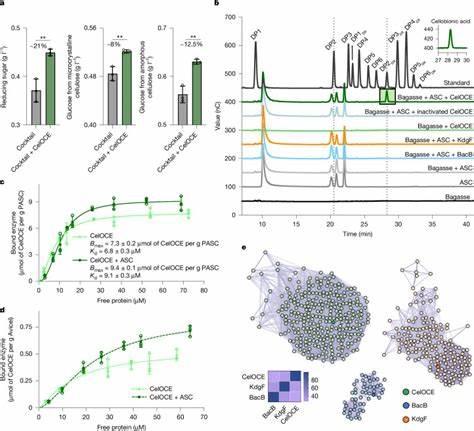
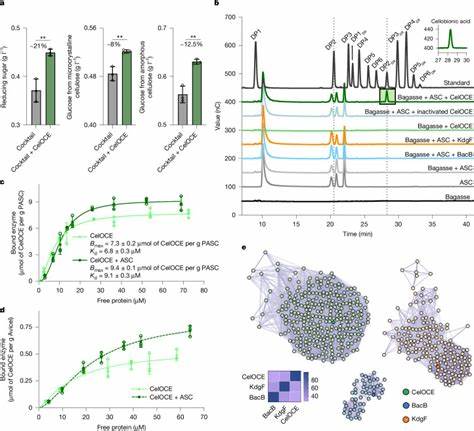
Zellulose ist der wohl häufigste erneuerbare Biomassebaustein auf der Erde und bildet das Grundgerüst pflanzlicher Zellwände. Trotz ihrer Verbreitung stellt die enzymatische Umwandlung von Zellulose eine große Herausforderung dar, da die Molekülstruktur dieser komplexen Polysaccharide mikrostrukturell hochkristallin und in einem engen Verbund mit Lignin und Hemicellulosen verankert ist. Traditionelle Hydrolyseverfahren stoßen oft auf Grenzen, was die Effizienz bei der Freisetzung verwertbarer Zucker, etwa Glukose, betrifft. Die jüngste Entschlüsselung eines bislang unbekannten Enzyms aus dem metagenomischen Bereich, der so genannten genetischen „Dunkelmaterie“, markiert einen entscheidenden Durchbruch in diesem Feld. Durch die systematische Metagenomanalyse mikrobieller Gemeinschaften, die seit Jahrzehnten auf mit Zuckerrohr-Bagasse bedecktem Boden bei einer brasilianischen Biorefinery siedeln, wurde ein neuartiges Metalloenzym identifiziert, das eine oxidative Spaltung von Zellulose katalysiert.
Dieses Enzym agiert als Monocopper-Protein mit einer einzigartigen Strukturform, die in einem kompakten Jelly-Roll-Faltblatt eingebettet ist und über eine besonders flache Bindungsstelle zur Zellulose verfügt. Das Enzym wirkt exo-typisch und zeigt eine ausgeprägte Regioselektivität am C1-Atom des Zellulosemoleküls, wobei es ausschließlich Cellobionsäure als Spaltprodukt erzeugt. Die kristallographische Analyse enthüllt, dass dieses Enzym in Form eines Homodimers vorliegt. Diese dimerische Konfiguration ist funktionell bedeutend, da eine Untereinheit in situ Wasserstoffperoxid generiert, welches als essentielles Co-Substrat für die oxidative Spaltung dient, während die andere Untereinheit direkt mit dem Zellulosesubstrat interagiert und die katalytische Aktivität ausführt. Mit dieser Eigenschaft etabliert sich das Enzym als selbstversorgend für den notwendigen Peroxid-Einsatz, was eine effiziente Oxidation unter industriell relevanten Bedingungen ermöglicht.
Die Bedeutung dieser metagenomischen Entdeckung geht über das reine Verständnis enzymatischer Mechanismen hinaus: Die Koexpression dieses Enzyms in einem Industriestamm des Fungus Trichoderma reesei führte zu einer statistisch signifikanten Steigerung der Glukosefreisetzung bei der enzymatischen Aufschlussbehandlung vorbehandelter lignocellulosischer Biomasse. Das weist eindrucksvoll auf die große biotechnologische Relevanz hin und könnte die Produktion von Biokraftstoffen und biobasierten Chemikalien maßgeblich verbessern. Im Vergleich zu bereits bekannten lytischen Polysaccharidmonooxygenasen (LPMOs), die eine wesentliche Rolle bei der oxidativen Depolymerisierung von Zellulose spielen, besitzt das metalloenzym eine grundlegend andere Struktur und Mechanik. Während LPMOs meist einen offenen aktiven Bereich besitzen und häufig von extern zugefügtem Peroxid profitieren, ist bei diesem neuen Enzym die Koordination des Kupfers in einer zugänglichen, aber eingebetteten Pocket-ähnlichen Umgebung angeordnet. Dies ermöglicht eine exo-gerichtete Oxidationsreaktion, die speziell die nicht-reduzierenden Enden von Zellulosefasern angreift.
Der daraus resultierende selektive Durchbruch der Zellulosekette führt zur Produktion von Cellobionsäure, welche als Ausgangspunkt für weitere Umwandlungswege in Bioprozessen genutzt werden kann. Die Entdeckung stammt aus der Analyse sogenannter metagenomischer „Dunkelmaterie“, einem genetischen Schatz, der aus bisher nicht kultivierbaren oder unbekannten Mikroorganismen besteht. Diese genetischen Ressourcen bleiben in der klassischen Mikrobiologie oft unzugänglich und bergen unbekannte Enzymfunktionen. Die erfolgreiche Identifikation und biochemische Charakterisierung des Enzyms ist ein Paradebeispiel für den Nutzen moderner metagenomischer und molekularbiologischer Methoden, unter anderem der Genomassemblierung, Proteomik, der Strukturbiologie mittels Röntgenstrukturanalyse sowie der präzisen Gentechnik mit CRISPR-Cas9. Auf ökologischer Ebene trägt das Enzym-Verständnis zum umfassenderen Wissen über mikrobiell vermittelten Biomasseabbau und den globalen Kohlenstoffkreislauf bei.
Die Beschleunigung und Effizienzsteigerung enzymatischer Zellulosekonversion ist zentral, um Agroreststoffe und pflanzliche Biomassen nachhaltig in energiereiche oder wertvolle chemische Produkte umzuwandeln. Vor diesem Hintergrund stellt die Entwicklung und Integration neuer, hochaktiver Enzyme wie dieses Metalloenzym einen Schlüsselbaustein für die Transformation zu einer biobasierten Wirtschaft dar. Die praktische Anwendung erstreckt sich über mehrere Ebenen industrieller Bioprocessing-Technologien: vom hochskalierbaren biotechnologischen Enzymcocktail über die Optimierung von Bioreaktorsystemen bis hin zur effektiven Nutzung verschiedenster pflanzlicher Ausgangsstoffe wie Zuckerrohrbagasse, Eukalyptusrinde oder anderer lignocelluloser Abfälle. Die Kombination des oxidativen Wirkmechanismus des neuen Enzyms mit konventionellen hydrolytischen Cellulasen führte zu synergetischen Effekten, insbesondere bei der Kopplung mit endo-glucanases, die innerhalb der Zellulosekette agieren und die Entstehung neuer Angriffspunkte unterstützen. Die genetische Verankerung des Enzyms in Trichoderma reesei, einem etablierten Industrie-Chassis, hebt zudem die industrielle Skalierbarkeit und Machbarkeit hervor.
Die Vermehrung und Fermentation im Pilotmaßstab (65-Liter bis 300-Liter Bioreaktoren) unterstreicht die Relevanz für die Produktion großer Enzymsmengen zu konkurrenzfähigen Kosten und mit hoher Aktivität. Zusätzlich zu den funktionellen Eigenschaften überzeugt das Enzym durch seine kompakte Struktur mit lediglich 115 Aminosäureresten. Diese geringe Größe macht das Enzym attraktiv für proteinchemische Modifikationen, Engineering und potenzielle Synthese künstlicher Enzyme. Das abweichende Kupfer-Bindungsverhalten, welches nicht auf der N-terminalen Histidinbindung der klassischen LPMOs basiert, bietet neue Perspektiven für die Entwicklung maßgeschneiderter Biokatalysatoren. Eine weitere Besonderheit ist die Selbstversorgung mit Wasserstoffperoxid, das durch einen der beiden aktiven Zentren der Homodimerstruktur vor Ort erzeugt wird.
Diese peroxygenase-ähnliche Funktion ermöglicht einen lokal konzentrierten Einsatz des fragilen Co-Substrats, was zu einer verbesserten Katalyse führt und den Bedarf externer Peroxidzugabe mindert. Die gleichzeitige Bindung an Zellulose über eine speziell geformte, flache Oberfläche sichert eine effiziente Substraterkennung und -bindung. Insgesamt erweitern die Erkenntnisse über dieses neuartige enzymatische System das heute bestehende Bild der mikrobiellen Zellulosezersetzung erheblich. Vor allem gibt die Entdeckung Einblicke in bisher unbekannte biologische Mechanismen zur Überwindung von Biomasserückständen und damit einhergehenden Herausforderungen beim Pflanzenzellwandabbau. Dieses Wissen ist wegweisend für künftige Forschungsansätze, die gezielt weitere, bislang unerschlossene Enzymklassen in mikrobiellen Gemeinschaften aufspüren und für Technologieplattformen nutzbar machen wollen.
In Zukunft versprechen weitere Studien die Aufklärung genauer Mechanismen auf atomarer Ebene, mögliche Verbesserung der katalytischen Effizienz durch Mutagenese und die Erforschung des Enzyms in Kombination mit anderen Systemen der Biomasseverwertung. Mögliche Anwendungen reichen von Biokraftstoffen über Biokunststoffe bis hin zur Herstellung pharmazeutischer Wirkstoffe aus nachhaltigen Rohstoffen. Die Entdeckung dieses metagenomischen „Dunkelmaterie“-Enzyms für die oxidative Zellulosekonversion steht exemplarisch für die Kraft moderner Interdisziplinarität zwischen Mikrobiologie, Enzymtechnik, Strukturbiologie und industrieller Biotechnologie. Sie verdeutlicht das verborgene Potenzial mikrobieller Gemeinschaften und eröffnet neue Horizonte bei der Umwandlung pflanzlicher Biomasse zu nachhaltigen Produkten und erneuerbarer Energie.