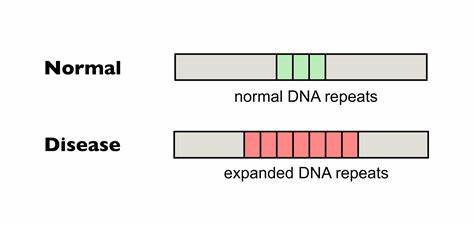
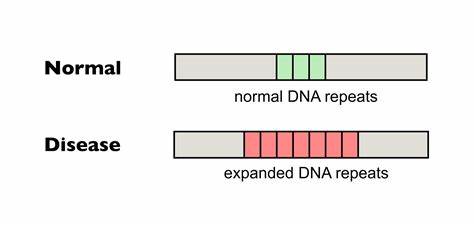
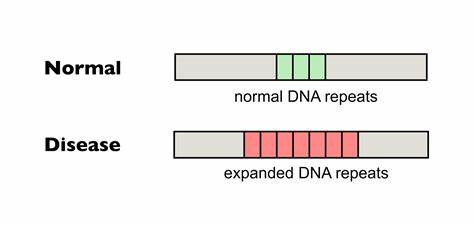
Die Huntington-Krankheit gehört zu den schwerwiegenden neurodegenerativen Erkrankungen, die durch eine pathologische Expansion von trinukleotidischen Wiederholungen im Huntingtin-Gen hervorgerufen wird. Genauer gesagt handelt es sich dabei um eine Verlängerung der CAG-Repeat-Sequenzen, die zu einer erweiterten Polyglutamin-Kette im Huntingtin-Protein führt. Diese unerwünschten Verlängerungen sind instabil und können während der Zellteilung oder Transkription weiter expandieren. Besonders problematisch ist die somatische Instabilität dieser Wiederholungen, die in verschiedenen Geweben, insbesondere im Zentralnervensystem, zu einer fortschreitenden Verschlimmerung der Symptome beiträgt. Zahlreiche Studien zeigen, dass die Länge der CAG-Repeat-Trakte sowie deren somatische Expansionen maßgeblich den Krankheitsbeginn, die Schwere und den Verlauf der Huntington-Krankheit beeinflussen.
Bisher gab es keine Behandlungsmöglichkeit, die direkt auf die Mutationen im Huntingtin-Gen abzielt und somit die Ursache der Erkrankung bei der Wurzel packt. Die jüngsten Fortschritte in der Gentechnologie haben jedoch eröffnet, dass gezieltes Editieren der trinukleotidischen Wiederholungen das Potenzial besitzt, die somatische Expansion zu reduzieren oder sogar zu verhindern. Eine besonders vielversprechende Technik ist das sogenannte Base Editing, das es erlaubt, einzelne Basen im DNA-Strang präzise zu verändern, ohne Doppelstrangbrüche zu verursachen. Wissenschaftler nutzten Cytosine Base Editors (CBEs), um gezielt dabei zu helfen, CAG-Sequenzen im Huntingtin-Gen an bestimmten Stellen in CAA-Sequenzen umzuwandeln – eine natü rliche Variation, die als Unterbrechung in der Wiederholung wirkt und die Stabilität des Gens erhöht. Forschungsergebnisse aus Zellkulturmodellen und Tierexperimenten belegen, dass durch das Einführen von CAA-Unterbrechungen in die CAG-Repeat-Trakte die somatische Expansion signifikant vermindert werden kann.
In Patientenzellen konnte gezeigt werden, dass bereits nach wenigen Tagen eine deutliche Zunahme von CAA-Unterbrechungen in den pathogenen CAG-Trakten zu verzeichnen war. Über mehrere Zellkultivierungspassagen hinweg blieben diese Editierungen stabil und es zeigte sich eine klare Verringerung der charakteristischen Repeat-Expansion. Im Vergleich wuchsen Fenotypen, die nicht editiert wurden, hingegen weiter und das Risiko von Instabilitäten nahm zu. Die Atomisierung der somatischen Instabilität ist jedoch nicht auf Zellkulturmodelle beschränkt: Im Htt.Q111 Mäusemodell, das das menschliche Huntingtin-Gen mit ~120 CAG-Wiederholungen beinhaltet, führte die Anwendung von AAV9-vermittelten Base Editing-Strategien ebenfalls zu einer dosisabhängigen und zeitintegrativen Einführung von CAA-Unterbrechungen im Gehirn.
Besonders im Cortex und Striatum, die von der Huntington-Erkrankung besonders betroffen sind, verringerte sich die durchschnittliche Länge der CAG-Repeat-Trakte und somit das Ausmaß der Expansion. Dadurch blieb das progressive Wachstum der pathogenen Repeat-Länge deutlich reduziert, was theoretisch einem verlangsamten Krankheitsverlauf entspricht. Interessanterweise scheint das Editieren innerhalb der Wiederholungsregion mit nur wenigen unerwünschten Nebenwirkungen einherzugehen. Die Analyse der Off-Target-Effekte mittels weitreichender Sequenzierungstechniken ergab, dass die meisten nicht beabsichtigten Editierungen in nichtkodierenden Genomregionen stattfanden und häufig zu Synonymen Veränderungen führten, die die Aminosäuresequenz des Proteins nicht verändern. Trotz der Tatsache, dass das sgRNA-Design für die Wiederholungen auch andere genomische Stellen mit ähnlichen Motiven anvisiert, reduzierte die hohe Anzahl von Mismatches die Off-Target-Aktivität beträchtlich.
Dies spricht für eine hohe Spezifität des Base Editors, insbesondere wenn sie mittels optimierter AAV-Serotypen und gezielter Applikationsrouten im ZNS zum Einsatz kommen. Neben Huntington's wurden vergleichbare Techniken auch bei anderen trinukleotidischen Repeat-Erkrankungen, wie der Friedreich-Ataxie, getestet. Dort werden GAA-Repeats in der FXN-Genregion durch Adenine Base Editing (ABEs) in nicht-pathogene triplet-Varianten wie GGA oder GAG umgewandelt, was ebenfalls zu einer Stabilisierung der Wiederholungsregion beiträgt. Damit zeigen diese Methoden, dass das gezielte Introducing von Unterbrechungen eine universelle Strategie zur Stabilisierung von genomischen Repeat-Sequenzen und der Linderung von darauf beruhenden neurologischen Krankheiten sein kann. Die Herausforderung liegt jedoch nach wie vor in der Verfeinerung der Editortechnologien hinsichtlich ihrer Effizienz, Spezifität und Sicherheit, insbesondere da AAV-basierte Lieferformen bisher eine anhaltende Base Editor-Expression vermitteln, was theoretisch das Risiko kumulativer Off-Target-Schäden birgt.
Fortgeschrittene Editor-Varianten mit reduzierter unbeabsichtigter DNA- oder RNA-Modifikation werden bereits in den Laboren entwickelt und getestet, um diese Risiken zu minimieren. Letztlich könnte die Früherkennung und Behandlung von Huntington-Patienten mit Editier-Strategien, die somatische Repeat-Expansion hemmen und im besten Fall rückgängig machen, einen Paradigmenwechsel in der Therapie der Erkrankung darstellen. Die Verzögerung des Krankheitsbeginns oder die Abschwächung des Verlaufs, durch ein stabilisiertes oder gar verkürztes CAG-Repeat, entspricht einem enormen therapeutischen Vorteil. Dabei ist vor allem auch die Kombination mit bereits bestehenden symptomatischen und unterstützenden Therapien zu betrachten, um eine ganzheitliche Behandlung zu ermöglichen. Die prädiktive Bedeutung von CAA-Unterbrechungen in menschlichen Populationen untermauert das Konzept weiter: Individualgenetische Analysen zeigen, dass das Vorhandensein dieser natürlichen Unterbrechungen mit einer etwa zwölf Jahre verzögerten Krankheitsmanifestation einhergeht.
Die Editing-Strategien erzeugen genetische Konstellationen, die dieser „natürlichen“ Variation entsprechen, was den behutsamen Ansatz bei der Genommanipulation zusätzlich unterstreicht. Zusammenfassend ist das Editieren der trinukleotidischen Wiederholungen mittels Base Editing eine äußerst vielversprechende molekulare Therapie, die die somatische Expansion bei Huntington’s und ähnlichen Erkrankungen eindämmt und damit potenziell den neurologischen Verfall verlangsamt oder sogar verhindert. Die Forschung auf diesem Gebiet bietet Hoffnung auf dringend benötigte gezielte Behandlungsansätze für Patienten, die bislang nur symptomatisch und unterstützend betreut werden können. Das Verständnis und die Weiterentwicklung dieser Technologie lassen erwarten, dass in den kommenden Jahren klinische Studien folgen werden, um diese therapeutischen Möglichkeiten am Menschen zu erproben und zu validieren.