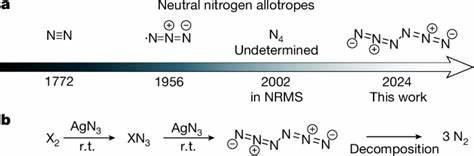
Stickstoff zählt zu den wichtigsten chemischen Elementen auf der Erde und bildet mit seiner molekularen Form N2 den Hauptanteil der Erdatmosphäre. Trotz seiner Allgegenwärtigkeit ist N2 die einzig stabile molekulare Allotropform, die natürlich vorkommt. Die Synthese neuer, neutraler Stickstoff-Elementarstoffe, die größer als N2 sind, galt lange Zeit als große Herausforderung – insbesondere aufgrund ihrer inhärenten Instabilität und der hohen Reaktivität. Ein bedeutender Durchbruch in der Chemie gelang nun mit der erfolgreichen Herstellung und Charakterisierung des neutralen Hexanitrogens C2h-N6, einem bisher unerreichten Stickstoff-Polynitrogenmolekül. Diese Entdeckung stellt nicht nur einen Meilenstein in der Grundlagenforschung dar, sondern eröffnet auch neue Möglichkeiten für energiereiche Materialien und nachhaltige Energiesysteme.
Die Faszination für Polynitrogene beruht vor allem auf ihrem enorm hohen Energiewert, der weit über dem von Traditionellen Energieträgern wie Wasserstoff, Ammoniak oder Hydrazin liegt. Da ihre Zersetzung ausschließlich harmlose Stickstoffgasmoleküle (N2) produziert, gelten sie als potenzielle umweltfreundliche Energiespeicher und Antriebsmaterialien. Die größte Schwierigkeit lag bisher jedoch in der Herstellung neutraler molekularer Stickstoffallotrope jenseits von N2, da diese Verbindungen meist sehr kurzlebig und extrem reaktiv sind. Die Herausforderung besteht darin, stabile molekulare Strukturen zu kreieren, die unter normalen Bedingungen erhalten bleiben können. Die jüngste Veröffentlichung eines Forschungsteams um Weiyu Qian, Artur Mardyukov und Peter R.
Schreiner beschreibt erstmals die gezielte Synthese von molekularem Hexanitrogen mit C2h-Symmetrie unter Raumtemperaturbedingungen. Die Synthese erfolgte durch die gasphasenreaktion von Chlor- oder Bromgas mit Silberazid (AgN3) unter reduziertem Druck. Die entstandenen Reaktionsprodukte wurden anschließend bei kryogenen Temperaturen in Argon-Matrizen bei 10 Kelvin eingefroren, was die Stabilisierung der reaktiven Spezies ermöglichte. Alternativ konnte das reine N6-Molekül als dünner Film bei flüssigem Stickstofftemperatur (77 Kelvin) präpariert werden, was seine außerordentliche Stabilität unter solchen Bedingungen unterstreicht. Die Charakterisierung des Hexanitrogens erfolgte durch eine Kombination von Infrarot- und UV-Vis-Spektroskopie, ergänzt durch Isotopen-Labeling mit ^15N zur eindeutigen Signalzuordnung.
Ergänzend stützten umfangreiche ab initio Rechnungen die experimentellen Daten. Die identifizierten Vibrationsbänder in der Infrarotspektroskopie zeigten charakteristische Signaturen, die klar vom N3-Azid-Radikalen und anderen Zwischenprodukten abgrenzbar sind. Die durch Isotopenversuche erzielten Verschiebungen bestätigten die Anwesenheit von zwei N3-Einheiten in unverwechselbarer Anordnung innerhalb des Moleküls. Die UV-Vis-Daten unterstützten zudem die Existenz und Stabilität des Moleküls und gaben Einblicke in die elektronischen Anregungen. Aus spektroskopischer Sicht besitzt das N6-Molekül eine eindeutig definierte Struktur, die sich deutlich von bekannten Stickstoffradikalen oder Kationen abgrenzt.
Die Struktur entspricht einem acyclischen N6-Molekül, auch als Hezaaza-1,2,4,5-tetraen oder Diazid bezeichnet, mit einer C2h-Symmetrie. Computergestützte Optimierungen zeigen dabei ein differenziertes Bindungsmuster mit Doppelbindungen entlang der Stickstoffkette und einer zentralen Bindung, die eine gewisse Single-Bindungscharakteristik besitzt, was die unerwartete kinetische Stabilität des Moleküls erklärt. Im Detail zeigen die Rechenmodelle, dass die Bindungslänge der N–N Doppelbindungen deutlich länger als im molekularen Stickstoff (N2) ist, was auf eine Abnahme der Bindungsstärke hindeutet. Dennoch verhindert die zentrale Bindung ein sofortiges Zerfallen des Moleküls in zwei N3-Radikale. Die gesamte Struktur zeichnet sich durch eine bemerkenswerte Verteilung der Elektronendichte aus, wobei die Terminalatome neutral sind, während leicht positive und negative Ladungen entlang der Kette verteilt sind.
Somit besitzt das Molekül eine subtile Balance an Elektronendichte, die seinem Zerfall entgegen wirkt. Wichtig ist, dass der Zerfall von N6 in drei molekulare N2-Gase energetisch begünstigt, aber kinetisch gehemmt erscheint. Die Aktivierungsenergie für diesen Zerfall beträgt laut den Rechnungen circa 14,8 kcal/mol, eine ausreichend hohe Barriere, um dem Molekül eine beachtliche Lebensdauer bei Raumtemperatur zu verleihen. Zusätzlich zeigen Tunneling-Berechnungen, dass quantenmechanische Tunnelprozesse den Zerfall nicht signifikant beschleunigen, was eine Halbwertszeit von mehreren Millisekunden bei 298 Kelvin bzw. Jahren bei kryogenen Temperaturen ergibt.
Dadurch wird verständlich, weshalb es möglich war, das Hexanitrogen in festem Argon und als Film stabil zu isolieren. Die energetische Bewertung der Verbindung macht deutlich, dass N6 zu den vielversprechendsten Kandidaten als Hochenergie- und Sprengstoffmaterial zählt. Die theoretisch berechnete Enthalpie des Zerfalls von N6 ist mit rund 185 kcal/mol deutlich höher als bei konventionellen Sprengstoffen wie TNT oder HMX. Gleichzeitig zeigen Berechnungen von Detonationsgeschwindigkeit und -druck, dass N6 vergleichbare bis bessere Werte als etablierte explosive Substanzen aufweist. Allerdings muss dabei beachtet werden, dass die praktische Anwendung noch durch die bisher sehr aufwendige und gefährliche Synthese eingeschränkt ist.
Die Synthese von N6 basiert auf der Verwendung von Silberazid als Ausgangsstoff, der als exzellenter Azid-Reagenzpartner fungiert. Im Reaktionssetup wird Gasphasenchlor oder Brom über festes AgN3 geleitet, wobei das entstehende N6 im Anschluss bei niedrigen Temperaturen durch schnelles Einfrieren fixiert wird. Die erfolgten Isotopenmarkierungen und vergleichenden Spektren zeigen, dass sich das Molekül unabhängig von der verwendeten Halogenquelle bildet und keine Halogene im Endprodukt verbleiben – ein klarer Hinweis auf pure Stickstoffverbindungen. Die Handhabung von Silberazid und Halogenaziden erfordert höchste Sicherheitsvorkehrungen, da diese Stoffe stark explosiv sind. Die Experimente wurden daher ausschließlich in extrem kleinen Mengen und unter Ausschluss von Funken, Berührungen mit Metallen oder Lichteinfall durchgeführt.
Der Erfolg dieser Synthese eröffnet nicht nur neue Forschungsperspektiven für weitere Stickstoffallotrope, sondern könnte langfristig zu einer neuen Klasse von Energiespeichern führen, die sowohl umweltverträglich als auch leistungsstark sind. Die mögliche Nutzung von N6-basierten Materialien in Raketentreibstoffen, Explosivstoffen oder als Energiespeicher für grüne Technologien steckt jedoch noch in den Kinderschuhen und erfordert weiterführende Untersuchungen hinsichtlich Stabilität, Skalierbarkeit und Sicherheitsaspekte. Fundamental betrachtet fordert die Entdeckung von neutralem Hexanitrogen das lange gehegte Paradigma heraus, dass höhere molekulare Stickstoffallotrope nur sehr kurzlebige, teils nur theoretische Spezies sind. Die Kombination aus experimenteller Matrixisolation, modernster Spektroskopie und Hochleistungsrechnungen demonstriert, dass neutrale Polynitrogene unter geeigneten Bedingungen durchaus isolier- und untersuchbar sind. In Zukunft werden weiterführende Experimente benötigt, um die Mechanismen der Bildung und des Zerfalls von N6 besser zu verstehen.





![Eidophor: 1950's space age video projection technology. [video]](/images/355D98C7-1AE8-4227-A4D4-95C22C5923EB)