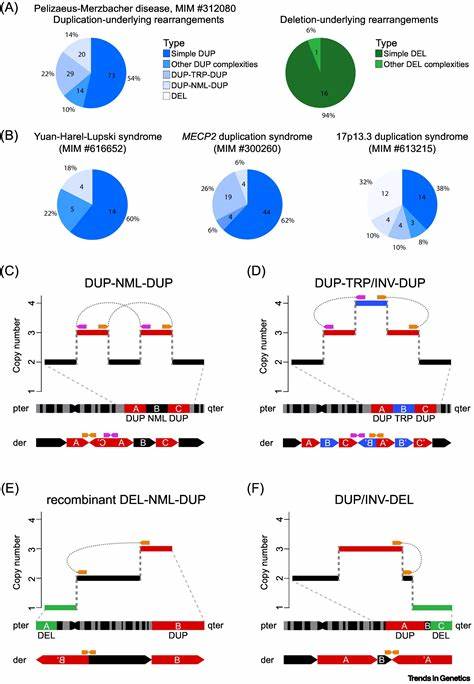
Die Chemie des Stickstoffs ist seit Jahrzehnten ein faszinierendes Forschungsfeld, das vor allem wegen des wichtigsten natürlichen Stickstoffmoleküls N2 besondere Aufmerksamkeit erhält. Stickstoffgas macht etwa 78 Prozent der Erdatmosphäre aus und gilt als ausgesprochen stabil und inert. Doch wissenschaftlich war es eine große Herausforderung, neutralen Stickstoff jenseits des zweiatomigen Moleküls N2 zu entdecken und zu stabilisieren. Polynitrogene, also Moleküle die ausschließlich aus mehreren Stickstoffatomen aufgebaut sind, besitzen eine enorme Energiedichte und bieten damit enormes Potenzial als saubere Energiespeichermaterialien. Ihre Synthese und Isolierung ist jedoch aufgrund der chemischen Instabilität und der hohen Reaktivität bislang meist nur theoretisch oder in ionisierter Form gelungen.
Die Synthese und Charakterisierung des neutralen Stickstoffallotropes Hexanitrogen in der symmetrischen C2h-Konfiguration (kurz: N6) stellt daher einen entscheidenden Durchbruch dar und könnte den Weg zu einer neuen Generation von Hochenergie-Materialien ebnen. Das Molekül Hexanitrogen (N6) besteht aus sechs Stickstoffatomen, die in einer linearen, aber nicht kettenartig reaktiven Struktur angeordnet sind. Traditionell ging man von der Unmöglichkeit aus, ein solches neutrales Molekül jenseits von N2 stabil zu halten, da zahlreiche Computermodelle einst niedrige Energiebarrieren für seine Zerlegung vorhersagten. Überraschenderweise konnte das N6-Molekül durch eine clevere Reaktionsführung und Kryotechnik erstmals bei Raumtemperatur synthetisiert werden. Dazu wurde eine gasphasenchemische Reaktion zwischen Chlor- oder Bromgas und dem explosiven Silberazid (AgN3) verwendet, bei der das entstehende N6-Molekül sofort bei sehr niedrigen Temperaturen in einer Argon-Matrix eingefroren und so stabilisiert wurde.
Die Methode ermöglicht es, das Molekül als isolierte Entität zu studieren, bevor es bei Erwärmung oder Lichteinwirkung wieder zerfällt. Die Identifikation von N6 erfolgte durch präzise spektroskopische Methoden. Sowohl Infrarot- als auch UV-Vis-Spektroskopie bestätigten die einzigartigen Schwingungs- und Elektronentransitionsmuster des Moleküls. Besonders aufschlussreich waren die Isotopenmarkierungsexperimente mit ^15N, bei denen durch den gezielten Austausch von Stickstoffisotopen eine genaue Zuweisung der Spektren möglich war. Diese bestätigten nicht nur die Existenz von zwei Azidgruppen innerhalb des Moleküls, sondern auch die vorgeschlagene C2h-Symmetrie, die für die Stabilität eine wichtige Rolle spielt.
Die experimentellen Beobachtungen wurden durch umfassende theoretische Berechnungen auf höchstem Niveau unterstützt. Computergestützte Quantenchemie auf Basis von CCSD(T)-Methoden und Dichtefunktionaltheorie half, die elektronischen Eigenschaften, das Bindungsverhalten sowie die möglichen Zerfallswege des Moleküls zu modellieren. Das N6-Molekül besitzt demnach eine Zusammensetzung, in der Doppel- und Einfachbindungen zwischen den Stickstoffatomen koexistieren. Die Analyse der Elektronendichte mittels Laplacianten und Elektronenlokalisationsfunktionen (ELF) offenbarte, welche Bindungen besonders schwach sind und somit bevorzugte Bruchstellen sind. Der Zerfall in drei Moleküle Stickstoff (N2) ist zwar exotherm und energetisch sehr günstig, jedoch ist die Reaktionsbarriere hoch genug, um dem N6-Molekül eine gewisse kinetische Stabilität zu verleihen – weswegen es bei niedrigen Temperaturen über längere Zeit existieren kann.
Diese Stabilität ist auch für potenzielle Anwendungen von enormer Bedeutung. Aufgrund der hohen Bindungsenergie von N2 setzt der Zerfall von N6 eine gewaltige Energiemenge frei. Berechnungen zeigen, dass die Zersetzung von N6 in drei N2-Moleküle um ein Vielfaches energetischer ist als die von herkömmlichen Sprengstoffen wie TNT oder HMX. Daraus ergibt sich ein großes Anwendungspotential als Hochenergieträger, der sauberer ist als fossile Brennstoffe oder andere chemische Energiespeicher, da bei der Zersetzung nur Stickstoffgas als Produkt entsteht – ungiftig und umweltfreundlich. Ein weiterer faszinierender Aspekt ist die photochemische Reaktivität des N6-Moleküls.
Bestrahlung mit Licht im sichtbaren Bereich führt zum schnellen Abbau, was gleichzeitig einen Weg zur kontrollierten Aktivierung bietet. Die gezielte Auslösung der Zerfallsreaktion mittels geeigneter Strahlung könnte in zukünftigen Energiespeicher- oder Antriebssystemen genutzt werden, um Energie bei Bedarf flexibel freizusetzen. Die Synthese von N6 gilt als eine Revolution in der Homonuklearchemie von Stickstoff, die lange Zeit nur Ionen oder Feststoffphasen mit komplexen Verbindungen zuließ. Ein Vergleich dazu ist die Entdeckung des pentazolaten Anions (cyclo-N5^−) in Salzen, das vor einigen Jahren für Aufsehen sorgte und neue Forschungszweige eröffnete. Im Unterschied dazu ist das neutrale N6-Molekül frei und stabil genug, um isoliert untersucht werden zu können – ein Novum, das Konventionen aufbricht.
Neben den molekularen Studieneinheiten bieten auch Festkörperformen des N6-Poulitons attraktive Perspektiven. Die bisher bekannten polymeren Stickstoffphasen bei hohem Druck und hoher Temperatur zeigen, dass neutraler Stickstoff in komplexen Strukturen existieren kann, wenngleich die Herstellung und Handhabung solcher Materialien herausfordernd bleibt. Das N6-Molekül nimmt dabei eine Pionierrolle ein, da es die mögliche Brücke zwischen moleculeler Chemie und makroskopischen Energiematerialien darstellt. Die Arbeiten zur Synthese und Charakterisierung von Hexanitrogen C2h-N6 wurden mit großer Sorgfalt durchgeführt. Die Experimente erforderten außergewöhnliche Sicherheitsvorkehrungen wegen der Explosivität und Instabilität der Ausgangsstoffe, insbesondere des Silberazids und der Halogenazide.
Die Forscher nutzten ultrakryogene Temperaturen und eine spezielle Matrixisolationstechnik, um die Reaktionsprodukte sofort einzufangen und zuverlässig zu identifizieren. In Kombination mit hochauflösenden Spektroskopieverfahren gelang es, die Existenz von N6 endgültig nachzuweisen. Langfristig eröffnen sich durch diese Innovation neue Forschungsfelder. Die gezielte Weiterentwicklung von Polystickstoffmolekülen könnte nach und nach stabile, neutrale Verbindungen mit noch höheren Atomzahlen und damit noch größeren Energiedichten hervorbringen. Auch theoretische Modelle profitieren von den experimentellen Daten und können so besser vorhersagen, welche Molekularstrukturen stabilisiert werden können.
Diese bahnbrechende Entdeckung hat darüber hinaus kommerzielle und technologische Implikationen. Energieerzeugung, Energiespeicherung und sogar Raketenantriebssysteme könnten in Zukunft von hochenergetischen, sauberen Stickstoffmolekülen wie N6 profitieren. Im Gegensatz zu herkömmlichen chemischen Treibstoffen, die oft giftige Verbrennungsprodukte erzeugen, setzt N6 nur Stickstoffgas frei – ein ideales, umweltfreundliches Abbauprodukt. Zusammenfassend lässt sich festhalten, dass das erstmals experimentell realisierte Hexanitrogen C2h-N6 eine neue Ära in der Chemie der neutralen Stickstoffallotrope einleitet. Es hebt altbekannte Grenzen in Stabilität und Synthese methodisch auf, liefert eine Grundlage für zukünftige Hochenergie-Materialien und setzt Impulse für nachhaltige Technologien der Energiewirtschaft.
Mit fortschreitender Forschung könnten sich die praktischen Anwendungen von N6 weiter entfalten, wodurch diese molekulare Entdeckung zu einem Eckpfeiler moderner chemischer Innovation wird.



![Landing a Model Rocket [video]](/images/D194C2B9-6274-4785-88D0-5D268F0A3CB7)