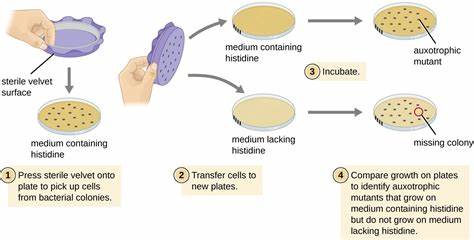
Die rasanten Fortschritte in der Genomsequenzierung haben zu einer Fülle von Daten zu genetischen Varianten im menschlichen Genom geführt. Jede Person trägt zahlreiche genetische Unterschiede, von denen viele potenziell gesundheitsrelevant sein können. Die Herausforderung liegt darin, zu verstehen, welche dieser Varianten tatsächlich Krankheitsursachen sind und welche nur harmlos vorkommen. Traditionelle Methoden wie In-vitro-Assays oder Analysen mit patientenspezifischem Material stoßen oft an Grenzen in Bezug auf Verfügbarkeit der Proben, Kosten und Komplexität. Vor diesem Hintergrund entwickelt sich ein innovativer Ansatz, der lebende Bakterienzellen – speziell humanisierte Escherichia coli-Stämme – als Plattform für enzymatische Untersuchungen nutzt, um menschliche Krankheitsmutationen funktionell zu charakterisieren.
Dieses neuartige Verfahren erlaubt hohe Durchsatzraten, Kosteneffizienz und biologische Relevanz. Das Prinzip hinter dem lebenden Bakterien-Enzymtest basiert auf der Idee, bakterielle Stoffwechselwege mit menschlichen Enzymvarianten zu ersetzen. E. coli besitzt einen Stoffwechselweg zur Glukoseverwertung, der evolutionär konserviert ist und wesentliche Ähnlichkeiten zur menschlichen Glykolyse aufweist. Indem spezifische bakterielle Enzyme durch deren menschliche Orthologe ersetzt werden, können die Auswirkungen von genetischen Varianten direkt anhand des Wachstumsverhaltens der Bakterien beobachtet werden.
Das bakterielle Wachstum spiegelt somit indirekt die funktionelle Aktivität des jeweiligen menschlichen Enzyms wider. Ein zentraler Vorteil dieses Modells ist, dass es die komplexen physiologischen Bedingungen eines lebenden Systems berücksichtigt und gleichzeitig die Manipulations- und Analysemöglichkeiten der Mikrobiologie nutzt. Ein konkretes Beispiel ist die Untersuchung von Varianten des menschlichen Enzyms Glukose-6-Phosphat-Isomerase (GPI), welches eine Schlüsselrolle in der Glykolyse trägt. Defekte in GPI führen beim Menschen zu hämolytischer Anämie, einem Zustand, bei dem die roten Blutkörperchen vorzeitig zerstört werden. In einer E.
coli-Stammlinie, in der das native pgi-Gen entfernt wurde, übernimmt das heterolog exprimierte menschliche GPI enzymatische Funktionen. Mutationen, die die Enzymaktivität reduzieren, führen hier zu einem verminderten Wachstumsvermögen der Bakterien. Die genaue Messung der Wachstumsraten erlaubt Rückschlüsse auf die schädlichen Auswirkungen einzelner Mutationen im menschlichen Gen. Weiterhin wurde das Modell auf das Enzym Glukose-6-Phosphat-Dehydrogenase (G6PD) angewandt, dessen Defizienz weltweit eine der häufigsten enzymatischen Erkrankungen ist und mit zahlreichen Varianten einhergeht. Die funktionelle Expression von humanem G6PD in E.
coli ermöglichte es, eine Vielzahl bekannter und bislang wenig charakterisierter Mutationen schnell zu screenen. Die daraus gewonnenen Daten korrelierten stark mit etablierten in-vitro-Aktivitätsmessungen und lieferten wertvolle Erkenntnisse über die Pathogenität einzelner Mutationen. Der Vorteil dieses lebenden Bakterientests – oft als LEICA (live enzyme assay in bacteria) bezeichnet – liegt auch in seiner Anpassungsfähigkeit für Wirkstofftests. Kleine Moleküle, die die Aktivität der humanisierten Enzyme modifizieren, können direkt im Bakteriensystem getestet werden. So wurden zum Beispiel für G6PD bekannte Aktivatoren und Inhibitoren erfolgreich identifiziert und pharmakologisch charakterisiert.
Dies belegt die Eignung von LEICA als Plattform für die Medikamentenforschung, insbesondere für Krankheiten, die durch enzymatische Fehlfunktionen bedingt sind. Die Anwendungspotenziale des Bakterienmodells gehen dabei über die Glykolyse hinaus. Auch Enzyme, die in anderen wichtigen Stoffwechselwegen des Menschen eine Rolle spielen, wie etwa Argininosuccinat-Lyase (ASL) im Harnstoffzyklus, können in E. coli exprimiert und mittels Wachstumsanalyse untersucht werden. Die Komplementierung auxotropher bakterieller Stämme mit humanem ASL ermöglicht so die Funktionsbestimmung krankheitsrelevanter Mutationen auch in komplexeren Stoffwechselnetzwerken.
Die Entwicklung dieser Methode adressiert wichtige Limitationen traditioneller Diagnostik. Klassische Enzymaktivitätsmessungen sind häufig auf Patientenproben angewiesen, deren Gewinnung und Handhabung aufwändig sein kann. In-vitro-Analysen mit rekombinanten Proteinen sind ressourcenintensiv und spiegeln oftmals nicht die physiologischen Rahmenbedingungen wider. LEICA dagegen bietet eine schnelle, skalierbare Lösung, die trotz des bakteriellen Wirts die für die Enzymfunktion relevanten zellulären Prozesse beibehält. Darüber hinaus ermöglicht der Ansatz eine homozyste Modellierung von Mutationen, also das Betrachten von Varianten in einem einheitlichen genetischen Hintergrund und mit kontrollierter Expression.
Dies reduziert den Einfluss von Variabilitäten etwa durch Genkopienzahl, Genexpression oder zellulären Kompensationsmechanismen, was in komplexen Geweben oftmals eine Herausforderung darstellt. So entsteht eine robustere und besser vergleichbare Plattform für die funktionelle Bewertung. Bei der Wirkstoffsuche eröffnet das Modell neue Wege für das High-Throughput-Screening. Chemische Bibliotheken können effizient durchforstet werden, um Verbindungen zu identifizieren, die die Aktivität spezifischer humaner Enzyme fördern oder hemmen. Die bakterielle Zelle stellt dabei ein lebendes Bioreporter-System dar, das biologische Relevanz mit einfacher Messbarkeit verbindet.
Dies kann zur Entdeckung neuer Therapeutika beitragen, unter anderem für seltene genetische Erkrankungen oder für weit verbreitete metabolische Störungen. Trotz der Vorteile sind auch Einschränkungen zu beachten. Da E. coli ein Prokaryot ist, können manche posttranslationale Modifikationen, wie sie in menschlichen Zellen vorkommen, nicht vollständig reproduziert werden. Darüber hinaus kann die Permeabilität der bakteriellen Membran die Aufnahme bestimmter Wirkstoffe beeinflussen, was bei der Interpretation von Ergebnissen berücksichtigt werden muss.
Um solche Effekte zu minimieren, werden Kontrollversuche mit Bakterien durchgeführt, die das native Bakterienenzym tragen, um Cytotoxizität oder unspezifische Effekte auszuschließen. Insgesamt stellt der lebende Bakterien-Enzymtest eine innovative, vielseitige und leistungsfähige Plattform dar, die das Potenzial hat, Forschung und Diagnostik im Bereich menschlicher genetischer Erkrankungen maßgeblich zu beeinflussen. Durch die Kombination von molekularbiologischer Präzision, kostengünstiger Praktikabilität und biologischer Aussagekraft gelingt es, den Funktionsbefund von genetischen Varianten schnell zu ermitteln und die Entwicklung personalisierter Therapien voranzutreiben. Die Zukunft wird zeigen, wie sich dieses Konzept weiterentwickelt, um weitere menschliche Enzyme abzudecken und in noch größeres Spektrum an Krankheiten vorzudringen. Dabei könnten technologische Fortschritte wie automatisierte Robotik, erweiterte Geneditierung und verbesserte Bakterienstämme die Effizienz und Genauigkeit des Systems weiter steigern.
Zudem eröffnet die Integration mit computergestützten Methoden der Genomdatenanalyse neue Dimensionen, um gezielt Mutationen zu identifizieren, die für eine pathologische Rolle verantwortlich sind. Für Patienten, Ärzte und Forscher bietet LEICA eine neue Hoffnung, die zwar in einem einfachen Bakterium wurzelt, aber weitreichende Auswirkungen im Kampf gegen genetisch bedingte Krankheiten verspricht. Dieses transdisziplinäre Verfahren verdeutlicht eindrucksvoll, wie Biotechnologie und Systembiologie sich ergänzen und innovative Lösungen für komplexe medizinische Fragestellungen schaffen können.