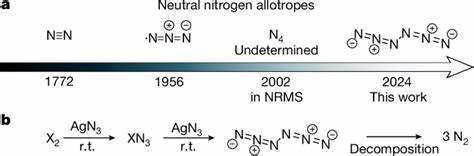
Stickstoff, das in seiner molekularen Form als N2 den größten Teil der Erdatmosphäre ausmacht, gilt als eines der reinsten und stabilsten Moleküle überhaupt. Seine chemische Trägheit und Umweltfreundlichkeit machen es zu einem einzigartigen Element. Umso bemerkenswerter ist der jüngste Durchbruch in der Chemie: Die Herstellung eines neutralen Stickstoff-Allotropten, bekannt als Hexanitrogen oder C2h-N6, ist Wissenschaftlern erstmals gelungen. Diese Entdeckung sorgt für große Aufmerksamkeit, nicht nur aufgrund ihrer fundamentalen Bedeutung, sondern auch wegen der sich daraus ergebenden Anwendungsmöglichkeiten in der Energiespeicherung und Materialwissenschaft. In diesem Bericht werden die Hintergründe, der Syntheseprozess, die Eigenschaften sowie die potenziellen Anwendungen des Hexanitrogens umfassend erläutert.
Polynitrogene, also Verbindungen, die ausschließlich aus mehreren Stickstoffatomen bestehen, sind seit langem theoretisch bekannt, bislang aber aufgrund ihrer extremen Instabilität experimentell weitestgehend unerreichbar. Die Bindung zwischen Stickstoffatomen ist kompliziert, da N2 eine sehr starke Triple-Bindung besitzt und andere Stickstoffverbindungen oft energetisch ungünstig sind. Dennoch wird intensiv nach neutralen Stickstoffmolekülen mit höherer Anzahl von Atomen gesucht, da diese als vielversprechende Hochenergiedichte-Materialien gelten. Sie könnten bei kontrollierter Zersetzung enorme Energiemengen freisetzen und dabei kaum umweltschädliche Rückstände hinterlassen, da das Zersetzungsprodukt im besten Fall wieder gasförmiges N2 ist. Früher wurden bisher nur wenige neutrale Stickstoff-Allotrope jenseits von N2 experimentell nachgewiesen.
Das bekannte Azid-Radikal mit drei Stickstoffatomen wurde bereits in den 1950er Jahren registriert, während Tetrazwischenspezies N4 nur spärlich und ohne genau strukturgebende Daten nachgewiesen wurden. Im Unterschied dazu sind ionische und geladene Stickstoffringe wie der Pentazolat-Anion (N5–) in verschiedenen Salzen und Feststoffen bereits isolierbar und erforscht worden. Diese ionischen Spezies haben ebenfalls hohes energetisches Potenzial, haben aber andere chemische Eigenschaften als neutrale Moleküle. Die neu entdeckte Form, C2h-symmetrisches Hexanitrogen (N6), unterscheidet sich deutlich von den bekannten Strukturen. Sie besteht aus zwei miteinander verbundenen Azid-Gruppen, die eine lineare Kette aus sechs Stickstoffatomen bilden.
Die Verbindung ist neutral, was für Polynitrogene ungewöhnlich und eine große Herausforderung bei der Synthese ist, da ungebundenes Nitrogen sonst meist zu kurzlebigen Radikalen neigt. Die Synthese von Hexanitrogen erfolgte erstmals durch die Reaktion von gasförmigen Chlor- oder Brommolekülen mit festem Silberazid (AgN3) bei Raumtemperatur. Das Reaktionsgemisch wurde sofort bei sehr niedrigen Temperaturen (10 Kelvin) in einer Argon-Matrix eingefroren, um das empfindliche N6-Molekül einzuschließen und zu stabilisieren. Eine Besonderheit dieses Verfahrens ist die Nutzung einer so genannten Matrixeinnistung, die als schonende Technik zum Nachweis reaktiver Intermediate dient. Zusätzlich ist es gelungen, eine reine N6-Schicht bei −196 °C (Flüssigstickstoff-Temperatur) anzulegen, was auf eine noch höhere Stabilität als angenommen hindeutet.
Die Identifikation von Hexanitrogen erfolgte über ein Bündel spektroskopischer Methoden. Die wichtigste war die Infrarotspektroskopie, wobei charakteristische Schwingungsbanden den Nachweis von N6 ermöglichten. Isotopenstudien mit ^15N markiertem Silberazid bestätigten die Zuordnung dieser Banden, da sich die Schwingungsfrequenzen bei unterschiedlichem Isotopengewicht erwartungsgemäß verschoben. Auch UV-Vis Spektren zeigten charakteristische elektronische Übergänge, die mit theoretischen Simulationen auf Basis ab-initio Rechnungen übereinstimmen. Begleitend zu den Experimenten wurde umfangreiche theoretische Arbeit durchgeführt, welche die Stabilität, Bindungsverhältnisse und Reaktionsmechanismen des Hexanitrogens erklärte.
Molekulare Berechnungen zeigten, dass das N6-Molekül energetisch ein lokales Minimum auf dem Potentialenergiefeld bildet und eine Hemmschwelle besitzt, die sein spontanes Zerfallen in kleinere Stickstoffmoleküle verzögert. Dies ermöglicht eine ausreichend lange Lebensdauer, um das Molekül im gefrorenen Zustand nachzuweisen. Gleichzeitig ist die Zerfallsreaktion hochexotherm, was das Potenzial für Energiefreisetzung unterstreicht. Die Bindungen innerhalb von N6 sind überraschend stabil ausgeprägt. Es bestehen Doppelbindungen zwischen bestimmten Stickstoffatomen, während die zentrale Bindung eher einfach ist.
Elektronendichteanalysen zeigten, dass die Elektronenverteilung so gestaltet ist, dass eine kinetische Stabilität entsteht, obwohl das Molekül thermodynamisch dazu neigt, in gasförmige N2-Moleküle zu zerfallen. Die Studien ergaben auch, dass die Bildung von zwei Azid-Radikalen durch Bruch der mittleren Bindung energetisch ungünstiger ist als der Zerfall zu drei N2-Molekülen. Dies erklärt, warum N6 tatsächlich erst zu N2 zerfällt und intermediäre Radikale kaum beobachtbar sind. Im Vergleich zu anderen bekannten Explosivstoffen wie TNT oder HMX weist Hexanitrogen eine deutlich höhere Heizwertdichte auf, mathematisch gerechnet fast das Zweifache. Zusätzlich könnten seine umweltfreundlichen Zersetzungsprodukte ein wichtiger Vorteil für zukünftige Anwendungen in der Energie- und Raketentechnik sein, da bei der vollständigen Zersetzung nur harmloses Stickstoffgas entsteht.
Die Gefahrenlage im Umgang mit N6 und den Ausgangsstoffen ist jedoch nicht zu unterschätzen. Silberazid und Halogenazide sind extrem explosiv und müssen unter strengsten Sicherheitsvorkehrungen in minimierten Mengen gehandhabt werden. Das gesamte Experiment erfordert daher spezialisierte Laborausstattungen und geschultes Personal. Aufgrund der hohen Energiemenge und der Stabilität bei niedrigen Temperaturen bieten sich für Hexanitrogen vielfältige Forschungs- und Entwicklungsmöglichkeiten. Denkbar sind unter anderem die Entwicklung neuer treibstoffeffizienter Raketentreibstoffe, sichere Energiespeichersysteme und der Einsatz in der Materialwissenschaft als Ausgangssubstanz für innovative Verbindungen mit hohem Stickstoffgehalt.
Der Erfolg bei der Synthese von Hexanitrogen zeigt, dass es möglich ist, theoretische Konzepte für polynitrogene Verbindungen in die Realität umzusetzen. Dies könnte der Beginn einer neuen Ära in der Chemie der Stickstoffallotrope sein, in der weitere Moleküle mit noch größerer Molekülgröße und komplexeren Strukturen hergestellt werden können. Zukünftige Studien werden sich daher auf die Charakterisierung der physikalischen Eigenschaften von N6, die Optimierung der Syntheserouten unter sichereren und effizienteren Bedingungen sowie die Erkundung der praktischen Anwendungspotenziale konzentrieren. Auch Fragen zur Stabilität unter verschiedenen Umweltbedingungen oder in Kombination mit anderen Materialien sind von großem Interesse. Insgesamt hat die Entdeckung von neutralem Hexanitrogen die langjährige Vorstellung von der Unerreichbarkeit neutraler polynitrogener Stickstoff-Allotrope herausgefordert und eröffnet neue wissenschaftliche und technologische Perspektiven.
Die Kombination aus experimentellen Methoden und modernen theoretischen Berechnungen hat diesen Durchbruch erst möglich gemacht und unterstreicht die Bedeutung interdisziplinärer Ansätze im Bereich der Chemie und Materialwissenschaft. Für Forscher, Energieexperten und Materialwissenschaftler ist Hexanitrogen nicht nur ein faszinierendes molekulares Beispiel, sondern ein möglicher Baustein für die nachhaltige Energieversorgung von morgen mit hoher Energiedichte und geringem ökologischen Fußabdruck. Es bleibt spannend zu beobachten, welche Entwicklungen sich aus dieser grundlegenden Entdeckung ergeben werden.