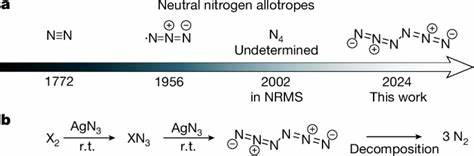
Stickstoff, als das häufigste Element der Erdatmosphäre, ist bekanntermaßen in der Natur nur als molekularer Stickstoff N2 in seiner stabilsten Form zu finden. Die Entdeckung höherer neutraler Stickstoffallotrope, also Moleküle, die ausschließlich aus Stickstoffatomen bestehen und mehr als zwei Stickstoffatome enthalten, war bislang eine große chemische Herausforderung. Aufgrund der extremen Instabilität dieser Verbindungen gelang es bisher nicht, neutrale Stickstoffmoleküle größer als N2 dauerhaft zu isolieren oder zu charakterisieren. Die Synthese eines solchen Moleküls verspricht jedoch enorme Vorteile, insbesondere im Bereich der Energiespeicherung, da Stickstoffmoleküle große Mengen an Energie freisetzen können, wenn sie in die stabile Form N2 zerfallen – wobei als einziges Endprodukt das umweltfreundliche Gas Stickstoff entsteht. Vor kurzem wurde ein großer Durchbruch erzielt: Wissenschaftler haben erstmals ein neutrales Stickstoffallotrop mit sechs Atomen hergestellt, bekannt als Hexanitrogen mit der Symmetrie C2h, kurz N6.
Die Arbeit, die in einer renommierten internationalen Fachzeitschrift veröffentlicht wurde, beschreibt die innovative Synthese dieses Moleküls bei Raumtemperatur sowie die umfassende spektroskopische Charakterisierung, die die Existenz und Stabilität von N6 eindeutig bestätigen. Die Herstellung von Hexanitrogen erfolgte über eine bemerkenswerte Verbrennungsreaktion zweier reaktiver Substanzen – Chlor- beziehungsweise Bromgas reagierte mit festem Silberazid (AgN3) unter reduzierten Druckbedingungen. Die so entstehenden gasförmigen N6-Moleküle konnten anschließend bei Temperaturen von nur 10 Kelvin in Argonmatrizen eingefangen werden, wodurch sie stabil gehalten und mittels Infrarot-, UV-Vis-Spektroskopie und Isotopenmarkierung analysiert werden konnten. Bemerkenswerterweise wurde darüber hinaus auch ein reines N6-Filmpräparat bei Flüssigstickstofftemperatur (77 Kelvin) hergestellt, was die unerwartete thermische Stabilität des Moleküls unterstreicht. Die Spektroskopie lieferte eindeutige Identifikationsmerkmale: charakteristische Infrarot-Schwingungen, die sich durch experimentelle Isotopenlabeling-Techniken bestätigten, sowie UV-Vis-Absorptionsspektren, die im Einklang mit quantenchemischen Computermodellen standen.
Die Berechnungen zeigten, dass die zentralen N–N Bindungen innerhalb von N6 besondere Doppelbindungscharakteristika aufwiesen, die für die Stabilität des Moleküls verantwortlich sind. Zusätzlich liefert die quantenmechanische Analyse, wie zum Beispiel die Berechnung der Elektronendichte und der Elektronenlokalisierungsfunktion, wertvolle Einblicke in potenzielle Zerfallsstellen des Moleküls und die Aktivierungsbarrieren der Zerfallsreaktionen. Diese Aktivierungsbarrieren sind entscheidend: Die Zerfallshürde von N6 in drei molekulare Stickstoffmoleküle N2 wurde auf etwa 15 kcal/mol berechnet – eine ausreichend hohe Barriere, die für eine beachtliche kinetische Stabilität sorgt. Zudem wirken quantenmechanische Tunnelprozesse, die bei ähnlichen Molekülen eine schnelle Zersetzung bewirken könnten, bei N6 deutlich weniger stark. Somit ist eine ausreichende Lebensdauer dieses allotropen Stickstoffmoleküls selbst bei Raumtemperatur möglich, um es physikalisch nachweisen und potenziell handhaben zu können.
Die energetischen Eigenschaften von N6 faszinieren ebenso. Vergleichsrechnungen ergaben, dass bei der Zersetzung von N6 enorme Energiemengen freigesetzt werden – bezogen auf das Molekulargewicht ist die Energieausbeute etwa doppelt so hoch wie bei klassischem TNT oder bekannteren hochexplosiven Verbindungen wie HMX. Daraus ergeben sich vielversprechende Perspektiven für Anwendungen als hochenergetische, nachhaltige Energiespeichermaterialien oder als Komponenten in Sprengstoffen, bei denen als Rückstand nur umweltneutraler Stickstoff entsteht. Die besondere Rolle von Silberazid als Ausgangsstoff ist hervorzuheben. Aufgrund seiner hohen Reaktivität und der Fähigkeit, unterschiedliche Stickstoffverbindungen zu erzeugen, bildet es den idealen Ausgangspunkt für die Synthese solcher Polymere.
Die kontrollierte Reaktion mit Halogenen wie Chlor oder Brom eröffnet neue chemische Wege zur Herstellung bisher unerreichter allotroper Formen von Stickstoff. Die kontrollierte Abscheidung und Matrixeinfangtechnologie bei tiefen Temperaturen ermöglicht die Stabilisierung ansonsten schnell zerfallender Zwischenprodukte und macht so ihre Charakterisierung durch spektroskopische Methoden erst möglich. Diese Entdeckung stellt nicht nur eine wichtige Erweiterung der fundamentalchemischen Kenntnisse rund um das Element Stickstoff dar, sondern ebnet auch den Weg für weiterführende Forschungen im Bereich der molekularen Energiematerialien. Die bisher erste Nachweisbarkeit eines neutralen Stickstoffallotrops mit mehr als zwei Atomen öffnet die Tür für die Suche nach weiteren Polymeren und komplexeren Strukturen – vielleicht in Form von stabilen Ringen, Ketten oder Käfigstrukturen. Es bleibt spannend, wie zukünftige Entwicklungen die Herstellung bei höheren Temperaturen oder gar in größerem Maßstab ermöglichen könnten.
Die Verbindung von experimenteller Arbeit und moderner quantenchemischer Methoden war dabei entscheidend. Nur durch die präzise Abgleichung von experimentellen Daten mit fortschrittlichen theoretischen Berechnungen konnte das Molekül eindeutig identifiziert und seine Struktur, Stabilität und Zerfallswege umfassend verstanden werden. Zusammenfassend zeigt die Synthese und Charakterisierung von Hexanitrogen C2h-N6 eindrucksvoll, dass der Traum von neutralen, höheratomigen Stickstoffallotropen Realität geworden ist. Die außergewöhnliche energetische Dichte und Umweltfreundlichkeit dieser Verbindung bieten Potenzial für innovative Anwendungen in Energie- und Materialwissenschaften. Die Forschungsergebnisse werden sicherlich die intensive Suche nach neuen Polynitrogenen anregen und könnten zukünftig zu nachhaltigen Hochenergiekomponenten oder alternativen Antriebsstoffen führen.
Diese Errungenschaft verdeutlicht, wie modernes chemisches Design und präzise experimentelle Techniken komplexe Probleme der Inertheit und Instabilität überwinden können. N6 ist somit mehr als nur eine weitere Stickstoffverbindung – sie ist ein wichtiger Schritt zur Entfaltung des vollen Potenzials eines Elements, das unser Leben und unsere Atmosphäre prägt.