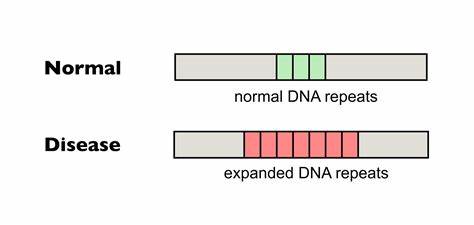
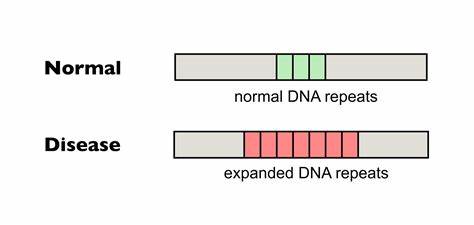
Die Huntington-Krankheit (HD) ist eine schwere neurodegenerative Erkrankung, die durch eine pathologische Expansion von CAG-Trinukleotidwiederholungen im HTT-Gen verursacht wird. Diese genetische Mutation führt zur schrittweisen Degeneration der Nervenzellen, was lebenslang fortschreitende motorische, kognitive und psychiatrische Symptome zur Folge hat. Trotz intensiver Forschung gibt es bislang keine kurative Therapie, die den Verlauf der Krankheit stoppen oder umkehren könnte. Neuere Entwicklungen im Bereich der Genom-Editierung und basenbasierten Technologien eröffnen hier jedoch vielversprechende Ansätze, mit denen somatische Repeat-Expansionen in betroffenen Zellen gezielt reduziert werden können. Die somatische Instabilität der CAG-Wiederholungen, also die weitere Ausdehnung der Repeat-Abschnitte in verschiedenen Geweben während der Lebenszeit eines Patienten, trägt entscheidend zum Fortschreiten der Huntington-Krankheit bei.
Untersuchungen zeigen, dass je länger die CAG-Trinukleotidsequenz, desto frühzeitiger erfolgt der Krankheitsausbruch und desto schneller schreitet die Neurodegeneration voran. Zielgerichtete Interventionen, die diese somatische Expansion bremsen oder verhindern, könnten daher das klinische Erscheinungsbild und die Prognose verbessern. Moderne Ansätze wie die basenbasierte Genom-Editierung setzen hier an, indem sie gezielt einzelne Nukleotide innerhalb der repetitiven CAG-Sequenzen verändern, ohne dabei die DNA komplett zu spalten. Dabei erfolgt die Umwandlung spezifischer Basenpaare, um natürliche, unterbrechende Sequenzen (beispielsweise CAA statt CAG) innerhalb der Repeat-Trakte einzuführen. Diese Unterbrechungen sind in der Natur bei manchen Individuen vorhanden und führen zu einer stabileren Wiederholung, die weniger anfällig für weitere Erweiterungen ist.
Somit ahmt die Genom-Editierung vorhandene genetische Varianten nach, die den Krankheitsverlauf mildern. In jüngsten Studien wurde gezeigt, dass mithilfe von cytosin- und adeninbasierter DNA-Bearbeitung CAA- und GGC-Unterbrechungen in den CAG-Repeats des HTT-Gens eingefügt werden können. Patientenzellen, die mit diesen sogenannten Base-Editoren behandelt wurden, zeigten deutlich weniger somatische Expansionen der Wiederholungstrakte. Die Behandlungen wurden ex vivo an Fibroblasten von Huntington-Patienten durchgeführt und führten zu einer markanten Reduktion der unerwünschten genetischen Instabilität. Neben Patientenproben konnten die Verfahren auch erfolgreich in vivo an Mausmodellen implementiert werden.
Durch die Nutzung von Adeno-assoziierten Viren (AAV) als gentechnische Vektoren gelang die gezielte Auslieferung der Base-Editoren in empfindliche Hirnregionen, die für die Huntington-Krankheit besonders anfällig sind, wie beispielsweise den Striatum und Cortex. Dort wurde eine stabile und effiziente Introduction der Unterbrechungen demonstriert, die innerhalb von Wochen zu einer signifikanten Verringerung der somatischen CAG-Expansion führte. Diese Fortschritte sind besonders bemerkenswert, da die bisherige Handhabung von trinukleotidischen Wiederholungen vor allem durch Herausforderungen wie Off-Target-Effekte, eingeschränkte Editierbarkeit repetitiver Sequenzen und langfristige Sicherheitspotenziale geprägt war. Die gewählte Methode erlaubt nämlich eine präzise Modifikation ohne Doppelstrangbrüche und minimiert so etwaige Risiken für unerwünschte Mutationen oder Chromosomeninstabilität. Wichtig ist auch die Erkenntnis, dass die Effekte der Basen-Editoren in vivo mit zunehmender Zeit stärker werden, was auf eine fortdauernde Aktivität und Ansammlung von Interruptions im Repeat-Trakt hindeutet.
Dies weist auf eine nachhaltige Wirkung hin, die für einen therapeutischen Nutzen von großem Wert sein kann. Die gezielte Einführung von Unterbrechungen im HTT-Gen wird dadurch zum strategisch sinnvollen Gegenentwurf zu der unkontrollierten Repeat-Expansion, die Ursache der HD-Symptomatik ist. Durch die Stabilisierung der CAG-Trakte können krankheitsbedingte Phänotypen womöglich verzögert oder abgeschwächt werden. Erste Analysen von Fragestellungen zur Vermeidung von schädlichen Mutationen an anderen genomweiten Standorten legen nahe, dass die Off-Target-Raten dieser Base-Editoren eher niedrig sind und meist zu neutralen oder bereits bekannten Varianten führen. Zukünftige Forschungen werden sich insbesondere der Optimierung der basenbasierten Intervall-Therapie widmen: Die Verbesserung der Vektorlieferung, die Präzisierung der Zelltyp-Spezifität sowie die Minimierung unerwünschter genomischer Veränderungen stehen dabei im Fokus.
Zudem sind Langzeitstudien essenziell, um potenzielle Sicherheitsrisiken und Wirksamkeitsprofile bei verschiedenen Krankheitsstadien zu bewerten. Die Therapie von Huntington mit Hilfe von Genom-Editierungstechnologien zeigt exemplarisch, wie die Verbindung von molekularer Präzisionstechnologie und Durchbrüchen in der Genetik zu einem Paradigmenwechsel in der Behandlung neurodegenerativer Erkrankungen führen kann. Die Reduktion somatischer Repeat-Expansionen markiert einen wichtigen Schritt hin zu personalisierten, genetisch fundierten Interventionen, die weit über symptomatische Ansätze hinausgehen. Zusätzlich zu Huntington können ähnliche Strategien auch bei anderen trinukleotid-assoziierten Erkrankungen wie Friedreich-Ataxie Anwendung finden. Dort stehen andere repetitive Sequenzen im Fokus, deren Stabilisierungen ebenso durch gezielte Basen-Editierung möglich sind.
Abschließend unterstreicht die Forschung die Bedeutung natürlicher genetischer Variation bei der Krankheitsmodifikation und zeigt, wie durch präzise genomische Modifikationen Pathologien gezielt beeinflusst werden können. Die vielversprechenden Resultate aus Patientenproben und Tiermodellen verdeutlichen, dass die Vermeidung somatischer CAG-Expansionen ein erreichbares Ziel darstellt, das die medizinische Versorgung von Betroffenen grundlegend verbessern könnte. Zwar befinden sich solche Therapien derzeit noch im experimentellen Stadium, doch die wissenschaftlichen Fortschritte lassen hoffen, dass bald effektive, ursächliche Behandlungsoptionen für Huntington und verwandte Erkrankungen bereitstehen werden. Für die Betroffenen und ihre Angehörigen eröffnet sich damit eine Perspektive, die lebensverändernde Verbesserungen ermöglicht und die Lebensqualität langfristig steigert.





![The Talent Stack [video]](/images/D34EDCCA-5B71-4217-995D-6395D79180BB)