Die Forschung im Bereich der Krebsbehandlung steht vor der Herausforderung, wirksame Therapien zu entdecken, die das Tumorwachstum gezielt hemmen ohne den gesamten Organismus massiv zu belasten. Eine vielversprechende Innovation ist die Verwendung von gentechnisch modifizierten Adipozyten, also Fettzellen, die so genetisch verändert wurden, dass sie Tumore im metabolischen Wettbewerb austricksen und dadurch deren Wachstum stark einschränken. Diese Methode basiert auf einem neuen therapeutischen Ansatz, der als Adipose Manipulation Transplantation (AMT) bezeichnet wird und aktuell in verschiedenen Krebsmodellen beeindruckende Erfolge zeigt. Tumore zeichnen sich durch ihre hohe Stoffwechselaktivität aus. Sie benötigen große Mengen an Nährstoffen wie Glukose und Fettsäuren, um sich energieintensiv teilen und ausbreiten zu können.
Gleichzeitig führt das Wachstum der Tumoren zu einer lokalen Mangelversorgung und Hypoxie, also Sauerstoffmangel im umliegenden Gewebe. Krebszellen passen sich durch metabolische Umprogrammierung an diese widrigen Bedingungen an, indem sie bevorzugt auf aerobe Glykolyse und Fettstoffwechsel setzen – ein Phänomen, das auch als Warburg-Effekt bekannt ist. Trotz zahlreicher Bemühungen, Medikamente gegen diese metabolischen Prozesse zu entwickeln, stellten sich bisher Limits hinsichtlich Wirksamkeit oder Nebenwirkungen heraus. Die methodische Entwicklung von AMT nimmt sich dieses Problems an, indem sie aus dem natürlichen metabolischen Reservoir des Körpers, nämlich dem Fettgewebe, einen therapeutischen Vorteil zieht. Weißes Fettgewebe kann durch gezielte molekulare Modulation in eine braune oder beige Form gewandelt werden, die sich durch verstärkte Stoffwechselaktivität auszeichnet.
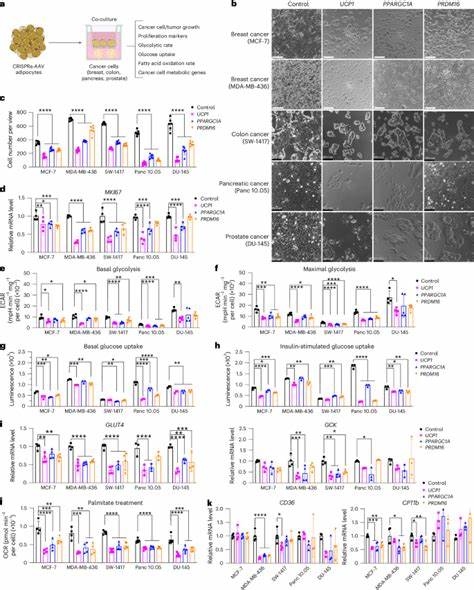
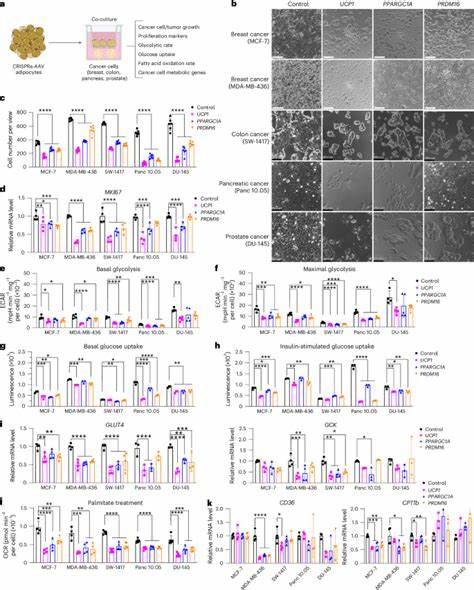
Durch eine CRISPRa-Technologie (CRISPR-Aktivierung) werden Gene wie UCP1, PRDM16 und PPARGC1A in menschlichen Adipozyten hochreguliert. Diese Gene sind zentral an der Thermogenese und der gesteigerten Energieumsatzrate in braunem Fettgewebe beteiligt. Durch die Aktivierung entsteht ein Zelltyp, der neben einer erhöhten Glukoseaufnahme auch eine optimierte Fettsäureverbrennung besitzt. Konkret führen diese energieintensiven adipösen Zellen zu einem direkten Nährstoffwettstreit mit dem Tumor. Durch ihre gesteigerte Aufnahme und Verstoffwechselung von Glukose und Fettsäuren entziehen sie den Krebszellen buchstäblich die lebenswichtigen Brennstoffe.
In Laborstudien mit verschiedenen Krebszelllinien, darunter Brust-, Darm-, Pankreas- und Prostatakrebs, wurde bei ko-kultivierten CRISPRa-modifizierten Adipozyten ein signifikant verringerter Zellwachstum der Tumorzellen beobachtet. Dies geht einher mit einer Reduktion von Markern für Proliferation, wie MKI67, und einer Herabsetzung der für die Glukose- und Fettsäureaufnahme wichtigen Gene. Die Übertragung der Forschungsergebnisse in vivo erfolgte durch die gleichzeitige Implantation von menschlichen adipösen Organoiden mit verändertem UCP1-Gen neben Tumorxenotransplantaten in immunsupprimierten Mäusen. Die Resultate überzeugten durch signifikante Tumorverkleinerung bei gleichzeitiger Abnahme von Hypoxie und der Neubildung von Blutgefäßen (Angiogenese), das bedeutet eine Unterbrechung der Versorgung des Tumors mit Sauerstoff und Nährstoffen. Zusätzlich wurden erhöhte Apoptoseraten in Tumorzellen festgestellt, was auf eine gesteigerte programmierte Zellteilung zurückzuführen ist und zusammen mit dem Nährstoffentzug den Tumorwachstum eindämmt.
Um die Funktionalität weiter zu unterstreichen, wurden adipöse Organoide nicht nur direkt neben den Tumoren implantiert, sondern auch an entfernten Stellen. Überraschenderweise führte auch die distale Implantation zu vergleichbaren Tumorhemmungen, was darauf schließt, dass systemische metabolische Veränderungen eine Rolle spielen. Analysen ergaben bei den behandelten Tieren verbesserte Glukosetoleranz, erhöhte Insulinsensitivität sowie niedrigere Plasmainsulinspiegel. Dies ist besonders relevant, da hohe Insulinspiegel als Wachstumsfaktor für Tumoren bekannt und mit schlechteren Prognosen assoziiert sind. Darüber hinaus wurde die Flexibilität von AMT durch den gezielten Einsatz eines induzierbaren CRISPRa-Systems demonstriert.
Durch Verwendung eines Tetracyclin-regulierbaren Elements lässt sich die Expression von UCP1 in den modifizierten Adipozyten zeitlich steuern, was für eine kontrollierte Therapie unerlässlich ist. Parallel dazu wurde ein innovatives Mikrowellengerüst aus biologisch abbaubarem Polycaprolacton entwickelt, um die adipösen Organoide in einem implantierbaren, reversibel entfernbaren Scaffold zu fixieren. Dies bietet nicht nur eine verbesserte Integration und Überlebensfähigkeit der transplantierten Einheiten, sondern erlaubt auch eine präzise chirurgische Kontrolle. Ein weiterer Höhepunkt der Studie war die Spezialisierung von AMT auf tumor-spezifische Stoffwechselwege. So konnten die Forscher bei einem auf Uridin angewiesenen pankreatischen Duktaladenokarzinom (PDA) die Expression von Uridine Phosphorylase 1 (UPP1) in den Adipozyten erhöhen.
Durch die gesteigerte Aufnahme und Verwertung von Uridin wurden die Krebszellen in ihrer Versorgung blockiert, was ebenfalls zu einer merklichen Wachstumshemmung führte. Dies illustriert die Anpassungsfähigkeit des Ansatzes auf verschiedene metabolische Bedürfnisse von Tumorarten. Die Möglichkeit, Fettgewebe durch minimal invasive Verfahren wie Liposuktion zu gewinnen, macht die klinische Anwendung von AMT besonders attraktiv. Das entnommene Fett kann ex vivo gentechnisch modifiziert und in Form von Adipozyten oder Organoiden zurück transplantiert werden. Gerade für Krebserkrankungen wie Brustkrebs, bei denen häufig nach Tumorentfernung rekonstruktive Eingriffe mit Eigenfetttransplantation durchgeführt werden, bietet sich hier eine ausgezeichnete Gelegenheit, therapeutische Fettzellen in den Prozess zu integrieren.
Dabei sprechen auch die immunologisch geringere Reaktivität von adipösen Zellen im Vergleich zu beispielsweise T-Zellen für eine niedrigere Abstoßung und bessere Verträglichkeit. Das AMT-Konzept kombiniert somit eine ausgefeilte Zellbiologie, gezielte Genregulation und innovative biomedizinische Technik und eröffnet damit eine neue Frontier in der onkologischen Therapie. Es stellt eine Alternative oder Ergänzung zu bestehenden metabolisch ausgerichteten Medikamenten und Therapien dar, die häufig mit Nebenwirkungen belastet sind. Die Dynamik der Nährstoffkonkurrenz fördert nicht nur eine lokale Tumorhemmung, sondern wirkt auch systemisch durch Modulation metabolischer Parameter. Nichtsdestotrotz gilt es, die Langzeitauswirkungen weiter zu erforschen, insbesondere um das mögliche Risiko von Cachexie, also dem krankhaften Muskel- und Fettabbau bei Krebspatienten, auszuschließen.
Die induzierbare Steuerbarkeit der Genexpression in den adipösen Zellen sowie die Möglichkeit, das Transplantat bei Bedarf chirurgisch zu entfernen, trägt maßgeblich zur sicheren Anwendung bei. Insgesamt lässt sich festhalten, dass die Implantation von genetisch optimierten Adipozyten eine bahnbrechende und vielseitige Strategie gegen verschiedene Krebsarten darstellt. Durch die metabolisch aktive Rolle des modifizierten Fettgewebes wird Tumoren der Zugang zu kritischen Energieträgern effektiv erschwert, was zu einer verlangsamten Progression und potenziell verbesserten Therapieergebnissen führt. Forschung und klinische Entwicklung werden in den kommenden Jahren zeigen, inwiefern AMT eine etablierte Behandlungsergänzung oder sogar Standardtherapie gegen Krebs sein kann.