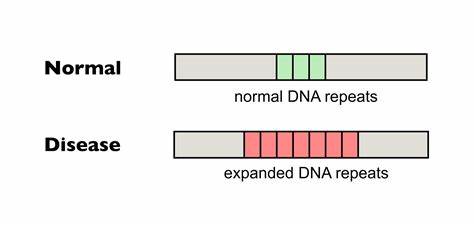
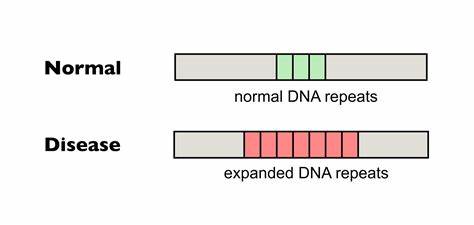
Huntington ist eine verheerende neurodegenerative Erkrankung, gekennzeichnet durch den pathologischen Ausbau bestimmter trinukleotidischer DNA-Sequenzen, sogenannter CAG-Repeats, im Huntingtin-Gen (HTT). Das Fortschreiten der Krankheit wird durch die kontinuierliche Expansion dieser Repeats in somatischen Zellen begünstigt, was wiederum zu einem beschleunigten Ausbruch und einer Verschärfung der Symptome führt. Neue Forschungen zeigen nun, dass durch gezieltes Gen-Editing die somatische Expansion dieser schädlichen Repeat-Abschnitte signifikant vermindert werden kann, wodurch sich Hoffnung auf zukünftige therapeutische Ansätze ergibt. Das Grundprinzip hinter Huntington ist, dass die Anzahl der CAG-Trinukleotidwiederholungen im HTT-Gen die Geschwindigkeit und Schwere des Krankheitsverlaufs bestimmt. Je länger die reine, ununterbrochene Repeat-Sequenz, desto höher das Risiko, dass sich die Struktur während der Zellteilung oder Transkription instabil verhält und sich weiter verlängert.
Diese Expandierungen verursachen Fehlfaltungen und toxische Aggregation des Huntingtin-Proteins, was letztlich zu neuronaler Degeneration führt. Die somatische Instabilität dieser Repeats ist ein zentrales, therapeutisches Ziel, da sie mit dem tatsächlichen Krankheitsverlauf korreliert. Etwas Besonderes dabei ist, dass natürliche Unterbrechungen in der Repeat-Sequenz, etwa durch Synonyme Substitutionen wie CAA statt CAG, die Stabilität deutlich erhöhen und das Fortschreiten der Erkrankung hinauszögern können. Diese sogenannten Interruptions sind also ein biologisches Schutzmechanismus-Muster, das bei einigen Menschen langsamer zum Krankheitsausbruch führt. Basierend auf diesem Konzept haben Forscher eine revolutionäre Strategie entwickelt: das präzise Einbringen solcher Interruptions in pathologische Repeats mittels Basen-Editing.
Hierbei handelt es sich um eine molekulargenetische Methode, die gezielte, einzelne Basenpaarsubstitutionen in der DNA ohne Double-Strand-Breaks erzeugt. Mittels cytosin- oder adeninbasierter Editoren können beispielsweise CAG-Tripletts in CAA verändert werden, ohne die Aminosäure-Sequenz des Proteins zu verändern, da beide Codons Glutamin codieren. Dies führt zu einer erhöhten Stabilität der Repeat-Region und verhindert weitere somatische Expansionen. In vitro Studien an Patientenzellen bestätigten die Effizienz dieses Ansatzes: Nach gezielter Behandlung zeigten die Zellen deutlich weniger somatische CAG-Expansionen. Dabei wurden Interruptions-Induktionen in bis zu über 60 Prozent der Pathogenen HTT-Allele gemessen.
Diese Veränderungen wurden zudem langfristig stabil gehalten über mehrere Zellteilungen hinweg, was ein positives Signal für die Persistenz der Therapieeffekte ist. Zur Testung im lebenden Organismus wurden optimierte Basen-Editoren mittels AAV9-Viren in neonate Mäuse mit humanisiertem HD-Genom injiziert. Die Modifikation führte zu einem signifikanten Rückgang der CAG-Expansionsraten insbesondere im zentralen Nervensystem, den für Huntington relevanten Geweben wie Striatum und Kortex. Die Effekte verstärkten sich tendenziell über die Monate nach Injektion, was zeigt, dass das Gen-Editing dauerhaft wirksam ist. Außerdem konnte beobachtet werden, dass sich die reinen CAG-Tracks zu Repeat-Sequenzen mit Interruptions wandelten, was die Grundlage für die erhöhte Stabilität bildet.
Detaillierte Analysen der möglichen Off-Target-Effekte zeigten, dass die meisten unerwünschten Basenveränderungen an nicht-kodierenden oder synonymen Stellen auftreten, die keine nachteiligen Proteinveränderungen verursachen. Einige wenige nonsynonyme Mutationen konnten allerdings identifiziert werden, deren mögliche funktionelle Auswirkungen noch weiter untersucht werden müssen, um die Sicherheit der Methode für therapeutische Anwendungen sicherzustellen. Der Erfolg des CAG-Basen-Editing im Huntington-Modell inspirierte vergleichbare Ansätze für Friedreich’s Ataxie, eine ebenfalls durch Triplet-Repeat-Expansion verursachte Erkrankung. Hier wird der GAA-Repeat im FXN-Gen bearbeitet, wiederum mit ähnlichen Mechanismen zur Einführung von Interruptions mittels adeninbasierten Editoren. Auch hier wurde eine wirksame Reduktion der somatischen Expansion in Patientenzellen und in entsprechenden Mausmodellen beobachtet, was die Vielseitigkeit und breite Anwendbarkeit des Basen-Editing-Ansatzes unterstreicht.
Neben den molekularen Änderungen zeigen erste Untersuchungen an Patientenzellen, dass der therapeutische Eingriff die Expression der betroffenen Gene verbessert. So erhöht sich nach dem Einbringen von Interruptions die Menge an FXN-mRNA im Fall der Friedreich’s Ataxie, was direkt mit einer Verbesserung der zellulären Funktion assoziiert ist und eine Korrektur der pathophysiologischen Mechanismen nahelegt. Trotz dieser vielversprechenden Ergebnisse sind vor der klinischen Anwendung weiterhin Herausforderungen zu bewältigen. Der Zugang zum zentralen Nervensystem, die Langzeitwirkung, mögliche Immunantworten auf virale Vektoren sowie das Minimieren von Off-Target-Effekten bleiben wichtige Forschungsfelder. Insbesondere die Entwicklung von Vektorsystemen mit noch höherer Spezifität und kontrollierter Expression könnte entscheidend sein, um die Sicherheit weiter zu erhöhen.
Die Möglichkeit, durch gezieltes Basen-Editing den molekularen Verlauf von Huntington direkt an der genetischen Ursache zu beeinflussen und die somatische Expansion der CAG-Trinukleotide zu vermindern, öffnet wichtige Perspektiven. Indem die Repeat-Sequenz stabilisiert und verlängerte Expansionszyklen verhindert werden, lassen sich potenziell Krankheitseintritt und -progression verzögern oder gar stoppen. Diese neue Methode hat das Potenzial, die Behandlung von Huntington und verwandten trinukleotid-bedingten neurodegenerativen Erkrankungen grundlegend zu verändern. Gleichzeitig bietet sie ein Modell für innovative therapeutische Ansätze, die auf präzisen Genom-Modifikationen basieren, ohne das Erbgut zu zerstückeln oder unkontrollierte Mutationen zu verursachen. Die Ergebnisse eröffnen somit die Chance auf eine sichere, effiziente und dauerhafte Behandlung dieser bislang unheilbaren Krankheiten.