Die menschliche Genetik ist ein komplexes Feld, das unser Verständnis von Erblichkeit, Gesundheit und Erkrankungen ständig erweitert. Eine der faszinierendsten Entwicklungen in der modernen Genetik ist die Erforschung sogenannter de novo Mutationen – genetische Veränderungen, die erstmals in Keimzellen, also Ei- oder Samenzellen, auftreten und somit an die nächste Generation weitergegeben werden. Jüngste Studien beleuchten, wie neben bekannten Faktoren wie dem Alter der Eltern auch die genetische Abstammung und der Lebensstil der Eltern, insbesondere das Rauchen, einen Einfluss darauf haben, wie viele und welche Arten von genetischen Veränderungen bei Kindern entstehen. Diese Erkenntnisse eröffnen neue Perspektiven auf genetische Vielfalt und Risiken seltener Erkrankungen. Der Erhalt der genetischen Integrität in Keimzellen ist lebenswichtig, da sie das Bindeglied zwischen den Generationen darstellen.
Die meisten genetischen Veränderungen, die spontan entstehen, sind entweder harmlos oder haben nur einen milden Einfluss. Dennoch tragen einige wenige dieser Mutationen zu schweren genetischen Erkrankungen bei, weshalb die Mutationrate in den Keimzellen evolutionär niedrig gehalten wird. Bislang war das Alter der Eltern, insbesondere des Vaters, als klarer Einflussfaktor für eine erhöhte Anzahl solcher Mutationen bekannt. Spermien vermehren sich häufig im Laufe des Lebens, wodurch sich mit steigendem väterlichem Alter mehr Fehler im Erbgut ansammeln. Jede weitere Lebensjahr des Vaters ergänzt rund 1,5 zusätzliche genetische Veränderungen, während das mütterliche Alter etwa 0,4 Mutationen pro Jahr hinzufügt.
Neuere groß angelegte Forschungen, die von führenden Instituten wie dem Wellcome Trust Sanger Institute und der University of Cambridge durchgeführt wurden, liefern nun weitere Einblicke. Durch die Analyse von rund 10.000 Genomen von Eltern-Kind-Trios aus dem 100.000 Genomes Project konnten Wissenschaftler fast 690.000 de novo Mutationen kartieren.
Die Studie untersuchte nicht nur das Alter der Eltern, sondern auch den genetischen Hintergrund – also die Abstammung der Familien – und Umweltfaktoren wie das Rauchen. Eine bereichernde Erkenntnis dieser Studie ist, dass genetische Unterschiede abhängig von der Herkunft geringe Abweichungen in der Anzahl der neuen Mutationen bedingen. So weisen Personen mit afrikanischer Abstammung durchschnittlich rund 67 neue de novo Mutationen pro Generation auf, während europäische, amerikanische und südasiatische Gruppen im Schnitt bei etwa 64 liegen. Diese Differenz ist zwar relativ gering, entspricht aber in etwa dem Effekt, den ein Vater zwei Jahre älter zu sein hätte. Offenbar können genetische Faktoren innerhalb unterschiedlicher Populationen die Mutationrate beeinflussen, auch wenn innerhalb einzelner europäischer Bevölkerungsgruppen keine signifikanten Einflüsse durch häufige Varianten gefunden wurden.
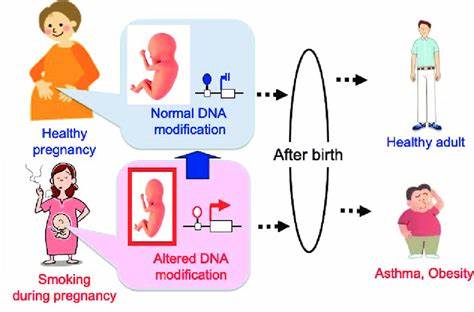
Die Ursachen für diese Unterschiede zwischen den Abstammungsgruppen könnten genetische Faktoren sein, aber auch Umwelteinflüsse, die regional variieren. Ein Beispiel dafür ist die Lebensumwelt, die unterschiedliche Belastungen mit sich bringt, wie Umweltgifte und Lebensgewohnheiten, welche die DNA der Keimzellen beeinflussen können. In diesem Zusammenhang fand die Studie auch einen Zusammenhang zwischen dem Rauchen der Eltern und einer erhöhten Zahl neuer Mutationen. Eltern mit dokumentierter Rauchgeschichte hatten Kinder mit einem etwa zwei Prozent höheren Durchschnitt an neuen genetischen Veränderungen. Obwohl dies nur eine geringe Erhöhung bedeutet – etwa eine zusätzliche Mutation im Verlauf des reproduktiven Lebens jedes Elternteils – ist der Effekt statistisch signifikant und vergleichbar mit dem Einfluss eines um ein Jahr älteren Vaters.
Diese Ergebnisse werfen Fragen bezüglich des direkten oder indirekten Einflusses des Rauchen auf. Es ist bisher nicht endgültig geklärt, ob das Rauchen selbst mutagen wirkt oder ob es mit anderen Schadstoffen oder Risikofaktoren korreliert. Nichtsdestotrotz öffnet die Studie ein neues Fenster, um den Einfluss von Lebensstil auf die Keimbahnmutationen zu verstehen und könnte zukünftige Forschungsansätze anstoßen, die Umwelteinflüsse auf die genetische Gesundheit besser erfassen. Die Bedeutung der Erkenntnisse liegt auch in ihrer Anwendung für die Medizinforschung. Die Rate und das Muster von Mutationen sind essenzielle Parameter in Studien zur Populationsgenetik sowie zur Identifizierung von seltenen genetischen Erkrankungen, die oft auf neuen Mutationen beruhen.
Bisher gingen viele Untersuchungen von einer einheitlichen Mutationrate bei verschiedenen Bevölkerungsgruppen aus. Diese Annahme könnte nun hinterfragt und angepasst werden, um die Genauigkeit und Aussagekraft von genetischen Studien zu verbessern. Darüber hinaus bietet das Verständnis darüber, wie Mitarbeiter Faktoren wie Abstammung und Lebensstil die genetische Variabilität beeinflussen, neue Chancen für präventive Maßnahmen. Beispielsweise könnten potenzielle Risiken, die mit Lebensgewohnheiten wie Rauchen verbunden sind, künftig in genetischen Beratungen berücksichtigt werden, um Familien gezielt zu informieren und Risiken zu minimieren. Die Forscher hinter der Studie betonen, dass sich die Mutationrate zwar größtenteils durch das Alter der Eltern erklären lässt, aber sowohl die genetische Herkunft als auch Umweltfaktoren wie Rauchen dennoch eine kleine, spürbare Rolle spielen.
Sie empfehlen dringend, in Zukunft umfangreichere Datensätze mit noch detaillierteren Informationen zu Umweltfaktoren zu erheben, um bisher unbekannte Einflüsse zu erforschen. Nur so lässt sich das komplexe Zusammenspiel von Genetik und Umwelt im Hinblick auf neue genetische Mutationen umfassend verstehen. Zusammenfassend ergänzt diese Forschung das Bild davon, wie wir genetische Unterschiede zwischen Individuen und Populationen erklären können. Sie zeigt, dass die genetische Abstammung eines Menschen zwar nur einen kleinen Einfluss auf neu auftretende Mutationen hat, dieser aber nicht zu vernachlässigen ist. Zudem unterstreicht sie die Bedeutung der elterlichen Lebensweise und dabei speziell des Rauchens auf die genetische Gesundheit zukünftiger Generationen.
Das Verständnis dieser Zusammenhänge ist nicht nur für die Grundlagenforschung relevant, sondern auch für die Entwicklung medizinischer Strategien und die genetische Beratung von Familien. Letztlich tragen Studien wie diese dazu bei, die Komplexität und Feinabstimmung von biologischen Prozessen zu entwirren, die über Generationen wirken. Sie machen deutlich, dass wir als Gesellschaft und Individuen nicht nur genetisch, sondern auch durch unsere Entscheidungen und Umwelteinflüsse zur genetischen Gesundheit unserer Nachkommen beitragen. Neue genetische Veränderungen sind Teil der natürlichen Menschheitsgeschichte, doch das Bewusstsein ihrer Ursachen hilft, potenzielle Risiken besser zu managen und unsere Gesundheit langfristig zu schützen.