Die Entstehung des menschlichen Herzens gilt als eines der faszinierendsten Kapitel der Embryonalentwicklung. Jahrzehntelang blieben die genauen Abläufe, wie sich Herzmuskelzellen im frühen Stadium eines Embryos organisieren und zusammenwirken, im Verborgenen. Erst jetzt ist es Wissenschaftlern gelungen, den entscheidenden Moment der Herzbildung erstmals lebendig in Bildern festzuhalten. Mithilfe modernster mikroskopischer Techniken wurde gezeigt, wie Herzmuskelzellen in einem Mäuseembryo sich spontan selbst organisieren und zu einem primären Herzrohr formen – eine Form, die später in die komplexen Strukturen eines voll entwickelten Herzens differenziert. Diese Entdeckung hat weitreichende Auswirkungen für das Verständnis von Entwicklungsprozessen, die Erforschung angeborener Herzfehler sowie die zukünftige regenerative Medizin.
Mit der Anwendung fortschrittlicher Lichtblattmikroskopie konnten Forscher über Stunden und sogar Tage hinweg lebende Embryonen in einer Kulturschale beobachten, ohne dabei deren Entwicklung zu beeinträchtigen. Die Herausforderungen bestanden zunächst darin, die Embryonen unter optimalen Bedingungen am Leben zu erhalten und gleichzeitig hochauflösende, schnelle Bildaufnahmen zu ermöglichen. Dank fluoreszierender Marker, die gezielt Herzmuskelzellen zum Leuchten brachten, entstand ein detailliertes Zeitrafferbild, das die Bewegung, Teilung und Organisation der als Kardiomyozyten bezeichneten Zellen dokumentierte. Die Aufnahmen zeigen, dass diese Zellen sich bereits früh – etwa sechs Tage nach der Befruchtung bei Mäusen – gezielt bewegen und differenzieren, anstatt zufällig zu wandern. Diese Entdeckung widerspricht bisherigen Modellen, die annahmen, dass Herzmuskelzellen eher chaotische Wanderungen vollziehen, bevor sie sich an der richtigen Stelle niederlassen.
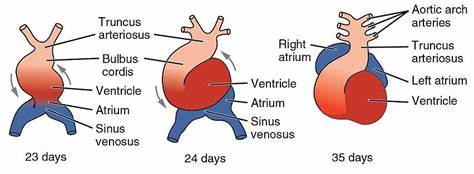
Stattdessen offenbart die Studie ein verstecktes Organisationsmuster, das die embryonale Entwicklung steuert und bereits in der Phase der Gastrulation beginnt. In dieser Phase richten sich die grundlegenden Körperachsen aus und differenzieren sich die Zellen in spezialisierte Zelllinien. Die präzise Bewegung der Herzvorläuferzellen deutet darauf hin, dass die kardiale Zellschicksalsbestimmung und das gerichtete Zellwandern viel früher im Prozess einsetzen, als bisher angenommen wurde. Der Herzentwicklung voraus gehen verschiedene komplexe biologische Prozesse. Zunächst entsteht aus undifferenzierten Zellen ein kardiogenes Feld, das die Vorläufer des Herzens enthält.
Diese Vorläuferzellen folgen spezifischen Pfaden, um sich in Bereiche zu gruppieren, die später die Ventrikel, die pumpenden Herzkammern, und Atrien, die Blutzufuhrkammern, bilden. An diesem Punkt entsteht das primitive Herzrohr, das die Grundlage für die spätere komplexe Herzanatomie bildet. Störungen in diesem Stadium können zu schweren angeborenen Herzfehlern führen – einer der häufigsten angeborenen Erkrankungen bei Neugeborenen. Die neuen Erkenntnisse liefern daher wertvolle Ansatzpunkte, um die Mechanismen hinter solchen Herzfehlern besser zu verstehen. Wenn sich das Herzrohr nicht korrekt entwickelt oder sich Zwischenwände nicht ordnungsgemäß bilden, kann dies zu Defekten wie Septumdefekten führen, bei denen Löcher zwischen den Herzkammern oder Vorhöfen bestehen bleiben.
Solche Defekte sind nicht nur strukturell gravierend, sondern beeinflussen auch die Lebensqualität und Überlebenschancen der betroffenen Kinder maßgeblich. Die Forschungsarbeit geht jedoch über das unmittelbare Verständnis der Herzbildung hinaus. Langfristig verspricht das Verfahren auch Fortschritte im Bereich der regenerativen Medizin. Beispielsweise könnten durch gezielte Steuerung der Herzzellen in der Entwicklung im Labor funktionale Herzzellen oder sogar ganze Herzstrukturen gezüchtet werden. Diese könnten dann in Zukunft genutzt werden, um beschädigtes Herzgewebe bei Patienten zu ersetzen oder zu reparieren.
Da Herzgewebe im Erwachsenenalter nur sehr begrenzt regenerationsfähig ist, ist dieser Ansatz von enormem medizinischem Potenzial. Neben der Bedeutung für medizinische Anwendungen betont die Studie auch die enorme technische Leistung, durch die diese Beobachtungen erst möglich wurden. Die Fähigkeit, lebende Embryonen so detailliert und langfristig zu beobachten, ohne deren natürliche Entwicklung zu stören, ist ein großer Fortschritt in der Embryonalbiologie. Früher waren derartige Beobachtungen entweder sehr kurzzeitig oder nur in begrenzter räumlicher Auflösung möglich. Lichtblattmikroskopie ermöglicht es nun, große Embryonen dreidimensional und über viele Stunden stetig zu beobachten, was eine völlig neue Qualität an Daten liefert.
Ermöglicht wurde die Studie am Great Ormond Street Institute of Child Health der University College London, wobei das Team um Dr. Kenzo Ivanovitch federführend war. Die Veröffentlichung im renommierten EMBO Journal unterstreicht die Bedeutung der Ergebnisse für die molekulare Entwicklungsbiologie und Medizin. Diese neuen Bilder und Erkenntnisse werfen auch spannende Fragen für die Zukunft der Forschung auf. So ist es beispielsweise interessant zu klären, welche molekularen Signale die geordnete Bewegung der Herzvorläuferzellen steuern.
Auch die Rolle der Genregulation und epigenetischen Mechanismen in dieser frühen Phase der Organausbildung steht im Fokus. Ein besseres Verständnis könnte nicht nur Herzfehler erklären, sondern auch andere Entwicklungsstörungen, die mit Frühphasen der Embryonalentwicklung verknüpft sind. Die Entdeckung trägt zudem wesentlich dazu bei, das menschliche Herz als evolutiv entwickeltes Organ besser zu verstehen. Das Herz ist das erste Organ, das während der Entwicklung funktionell aktiv wird, da der Embryo früh mit Sauerstoff und Nährstoffen versorgt werden muss. Die ausgeklügelten Bewegungsmuster der Herzmuskelzellen zeigen den hohen Grad evolutionärer Komplexität, mit der die Natur die lebenswichtige Funktion des Herzens sichert.
Zusätzlich hat das wissenschaftliche Vorgehen durch die Nutzung fluoreszierender Markierungen des Zelltyps gezeigt, wie moderne bildgebende Verfahren genutzt werden können, um komplexe biologische Abläufe anschaulich und nachvollziehbar darzustellen. Solche Technologien haben sich als unverzichtbar erwiesen, um die Dynamik lebender Zellen in Echtzeit zu verfolgen und zu analysieren. Für Familien, medizinische Fachkräfte und Wissenschaftler eröffnen sich durch diese Forschung neue Perspektiven. Verständnis und Diagnose von Herzfehlern können künftig präziser und frühzeitiger erfolgen. Interventionen in der Embryonalentwicklung könnten eventuell sogar möglich werden, um Defekte präventiv zu verhindern.
Ebenso bieten die gewonnenen Erkenntnisse ein solides Fundament, auf dem Therapien basieren können, die in den kommenden Jahren die Behandlung von Herzerkrankungen revolutionieren könnten. Die Momentaufnahme der Herzbildung in Bildern ist somit weit mehr als eine wissenschaftliche Sensation: Sie markiert einen Meilenstein in der Entwicklungsbiologie, der Medizin und Technik. Ein tiefgehendes Verständnis, wie das Herz als lebenswichtiges Organ entsteht, ist ein Schlüsselfaktor für zukünftige medizinische Innovationen und könnte vielen Patienten das Leben erheblich verbessern. Die Zeitrafferaufnahmen geben einen seltenen Einblick in den Ursprung des Lebens – ein faszinierender Blick auf die Kraft und Präzision der Natur bei der Erschaffung des menschlichen Herzens.