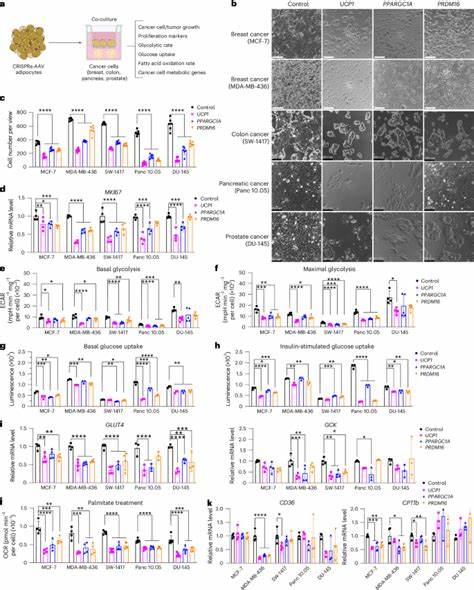
Krebs stellt weltweit eine der größten Herausforderungen in der Medizin dar, da Tumore mit einer Vielzahl komplexer Mechanismen wachsen und metastasieren. Eine dieser Besonderheiten ist die gesteigerte Fähigkeit von Tumorzellen, Nährstoffe wie Glukose und Fettsäuren aufzunehmen und zu verwerten, um ihr schnelles Wachstum zu unterstützen. Traditionelle Krebstherapien konzentrieren sich vielfach auf die direkte Bekämpfung oder Entfernung der Krebszellen, doch neue Ansätze rücken nun die metabolischen Besonderheiten des Tumormikromilieus in den Vordergrund. Ein besonders innovativer Ansatz basiert auf der Implantation von gentechnisch veränderten Adipozyten – den Fettzellen – um den Tumor im Wettbewerb um Nährstoffe zu besiegen. Diese Methode, bekannt als Adipose Manipulation Transplantation (AMT), setzt auf das Potenzial von Adipozyten, Energieressourcen effizient aufzunehmen und zu verstoffwechseln, was dem Tumor die wichtigen Substrate entzieht und somit dessen Progression hemmt.
Menschliche Adipozyten können durch gezielte CRISPRa-Technologie dazu gebracht werden, eine braune Fettzellen-ähnliche Funktion zu entwickeln. Das bedeutet, sie erhöhen den Energieverbrauch durch einen Prozess, bei dem Nährstoffe vermehrt als Wärme verbrannt werden – ein Phänomen, das normalerweise bei braunem Fettgewebe beobachtet wird. Dieser Prozess wird durch Gene wie UCP1 (Uncoupling Protein 1) gesteuert, dessen Hochregulierung in den modifizierten Fettzellen zu einer gesteigerten Aufnahme von Glukose und Fettsäuren führt. In mehreren in vitro und in vivo Untersuchungen wurde gezeigt, dass co-kultivierte oder neben Tumorzellen implantierte „gebräunte“ Adipozyten das Tumorwachstum signifikant reduzieren können. Verschiedene Krebsarten, darunter Brust-, Darm-, Bauchspeicheldrüsen- und Prostatakrebs, profitierten von diesem Ansatz.
Die mutierten Fettzellen nehmen effektiv Nährstoffe weg, was zu einem Rückgang des Tumorstoffwechsels führt – insbesondere zu verringerter Glykolyse und Fettsäureoxidation in den Tumorzellen. Die Implantation von adipösen Organoiden, dreidimensional kultivierten Fettzellaggregaten, bietet hierbei einen zusätzlichen Vorteil, da sie das natürliche Mikromilieu des Fettgewebes sehr gut nachbilden. In genetisch veränderten Mausmodellen für Bauchspeicheldrüsen- und Brustkrebs konnte durch die lokale oder sogar distale Implantation solcher Organoide das Tumorwachstum unterbunden werden. Dabei wurden nicht nur das Tumorvolumen reduziert, sondern auch eine verminderte Bildung neuer Blutgefäße und Hypoxie im Tumorgewebe beobachtet, was auf eine gestörte Tumormikroumgebung hinweist. Eine weitere interessante Erkenntnis ist, dass der Effekt der Tumorunterdrückung durch externe Ernährungsfaktoren beeinflusst werden kann.
So wurde festgestellt, dass eine Ernährung mit hohem Fettanteil oder Zuckerzusatz die Wirksamkeit der AMT-Strategie abschwächt. Dies unterstützt den zugrunde liegenden Mechanismus der Nährstoffkonkurrenz, indem überschüssige Nährstoffe den Tumorzellen zur Verfügung stehen und deren Wachstum begünstigen, trotz der „gebräunten“ Adipozyten. Neben der Hochregulierung von UCP1 wurden auch andere Metabolismus-bezogene Gene untersucht. Beispielsweise konnte die Aktivierung von Uridinphosphorylase 1 (UPP1) in Fettzellen die Verfügbarkeit von Uridin verringern, eine alternative Energiequelle für bestimmte Bauchspeicheldrüsenkarzinome. Dieser Befund spricht für die Anpassbarkeit der AMT-Technologie und deren Einsatz, um unterschiedliche Stoffwechselwege von Tumoren zu adressieren.
Wichtig für die praktische Anwendung ist, dass die gentechnisch modifizierten Fettzellen und Organoide aus Patientenmaterial selbst hergestellt werden können. So können beispielsweise Fettzellen aus Brustgewebe von Krebspatientinnen entnommen, ex vivo modifiziert und anschließend zurück transplantiert werden. Dieser autologe Ansatz minimiert immunologische Risiken und passt sich dem individuellen Tumorstoffwechsel an. Ein weiterer Vorteil der Methode liegt in der Möglichkeit einer kontrollierten Induktion der durch CRISPRa aktivierten Gene mittels induzierbarer Systeme, etwa durch Tetracyclin. Ebenso erlauben biomechanische Implantatplattformen mit Zell-Scaffolds die gezielte Platzierung und bei Bedarf Entfernung oder den Austausch der transplantierten Fettzellen, was eine flexible Therapiegestaltung ermöglicht.
Diese strategische Nutzung von Fettzellen als „Spritwächter“ des Stoffwechsels verlängert das therapeutische Arsenal gegen Krebs deutlich. Anders als konventionelle Medikamente, die oft gezielte Enzyme oder Transporter hemmen, funktioniert AMT durch die Umleitung von Nährstoffen auf körpereigene Zellen, die der Tumorzelle den Zugang verweigern. Das Resultat ist eine metabolische Erschöpfung des Tumors und folglich Wachstumshemmung. Zudem zeigt sich ein positiver systemischer Effekt: Die implantierten braunen Adipozyten verbessern die Glukose-Toleranz und Insulinsensitivität des Körpers, was ebenfalls tumorhemmend wirkt, da erhöhte Insulinspiegel als Wachstumsfaktor für viele Tumore gelten. In den untersuchten Mausmodellen zeigte sich daher nicht nur eine lokale, sondern auch eine systemische Entlastung des Organismus, was einen wichtigen Aspekt für die Verträglichkeit der Behandlung darstellt.
Selbstverständlich gibt es Herausforderungen auf dem Weg zur klinischen Anwendung. Die Dauerwirkung der Implantate, mögliche Auswirkungen auf den Energiehaushalt, insbesondere das Risiko einer Kachexie (krankhafter Gewichtsverlust), und die sichere Kontrolle der gentechnischen Modifikationen müssen intensiv erforscht werden. Doch die Möglichkeit, transgene Expression reversibel zu steuern und implantierte Organoide mit biomechanisch unterstützten Geräten kontrolliert einzusetzen, bietet bereits heute Lösungen gegen potenzielle Nebenwirkungen. Nicht nur für die Therapie fortgeschrittener Tumore eröffnet AMT neue Perspektiven, sondern auch für die Prävention bei Patient*innen mit hohem Krebsrisiko, beispielsweise solchen mit genetischen Prädispositionen wie BRCA1/2-Mutationen. Ex-vivo behandeltes Adipozytenmaterial aus gesunden oder vorsorglich entnommenen Geweben kann laut jüngsten Studien das Wachstum präkanzeröser Zellverbände hemmen.
Im Fokus zukünftiger Forschung steht die weitere Optimierung und Personalisierung der Technologie. Durch das gezielte Hochregulieren mehrerer Gene in Adipozyten, die individuellen metabolischen Profile der Tumore anpassen und weitere metabolische Engpässe schaffen können, ist eine dynamische, patientenspezifische Krebsbehandlung denkbar. Ebenso wird die Kombination von AMT mit klassischen Krebstherapien, wie Chemotherapie oder Immuntherapie, geprüft, um synergistische Effekte zu erzielen. Die einfach zu entnehmenden Fettzellen bieten zudem einen biotechnologischen Vorteil: Der etablierte klinische Umgang mit Liposuktion und Fetttransplantationen bringt eine unkomplizierte Plattform für die Herstellung und Rücktransplantation der modifizierten Adipozyten mit sich. Da sie eine geringere immunologische Abstoßung als andere Zelltypen hervorrufen, besteht sogar die Chance, adipöse Zellen als „Off-the-Shelf“-Produkte zu entwickeln.
Zusammenfassend lässt sich sagen, dass die Implantation von gentechnisch veränderten Adipozyten ein revolutionäres Konzept darstellt, das die Krebsbehandlung stärker auf den Stoffwechsel des Tumors ausrichtet. Durch die metabolische Erschöpfung und gleichzeitige Verbesserung der systemischen Stoffwechsellage entsteht eine zweifache therapeutische Wirkung. Diese Methode hat das Potenzial, herkömmliche Therapien zu ergänzen und in Zukunft möglicherweise selbst die Basis personalisierter Krebstherapien zu bilden. Das Zusammenspiel aus molekularer Biotechnologie, Stoffwechselbiologie und klinischer Zelltherapie macht AMT zu einer interdisziplinären Innovationsplattform. Die Aussicht, Patienten eigene Fettzellen zu entnehmen, gezielt genetisch zu „schulen“ und wieder zu implantieren, eröffnet spannend Perspektiven in der Krebsbekämpfung.
Die Forschung ist noch jung, doch die bereits heute vorliegenden Ergebnisse versprechen eine neue Ära der onkologischen Therapie, die vom Kampf um Nährstoffe im Mikromilieu geprägt sein wird.