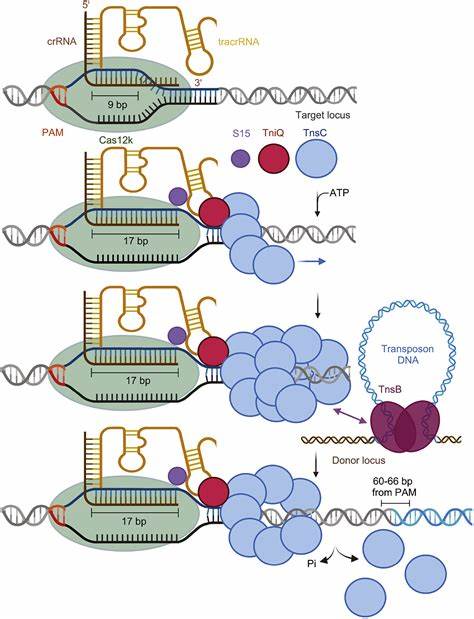
Die Gentherapie hat in den letzten Jahren enorme Fortschritte gemacht, doch die Einführung einer vollständig personalisierten, auf CRISPR basierenden Behandlung für einen einzelnen Patienten stellt einen Quantensprung dar. Im Mai 2025 wurde erstmalig ein Säugling mit einer individuell entwickelten CRISPR-Therapie behandelt – und das in einem beispiellosen Zeitraum von nur sechs Monaten. Diese beeindruckende Leistung zeigt, wie schnell innovative biomedizinische Lösungen von der Forschung bis zur klinischen Anwendung gelangen können, wenn interdisziplinäre Zusammenarbeit und modernste Technologien Hand in Hand gehen. Der Fall betrifft den kleinen Patienten KJ, geboren mit einer extrem seltenen und lebensbedrohlichen genetischen Erkrankung namens CPS1-Mangel (Carbamoylphosphat-Synthetase-1-Defizienz). Diese Störung des Harnstoffzyklus führt dazu, dass der Körper des Kindes Proteine nicht richtig abbauen kann, was zu einer gefährlichen Anhäufung von Ammoniak im Blut führt.
Ohne Behandlung liegt die Sterblichkeit in der frühen Kindheit bei etwa 50 Prozent. Im akuten Zustand erfordert die Krankheit eine intensive stationäre Betreuung, strenge Diätvorgaben und den Einsatz spezieller Medikamente, um die toxischen Auswirkungen zu kontrollieren. Für KJ war die Aussicht auf eine Lebertransplantation die bisher einzige Hoffnung. Die Entwicklung der individuellen CRISPR-Therapie war eine beispielhafte Teamleistung von Wissenschaftlern und Ärzten verschiedener Institutionen, darunter das Innovative Genomics Institute (IGI) der University of California, Berkeley, das Children’s Hospital of Philadelphia (CHOP) und die University of Pennsylvania. Unter der Leitung von renommierten Forschern wie Jennifer Doudna, Nobelpreisträgerin und Pionierin der CRISPR-Technologie, sowie den Klinikärzten Rebecca Ahrens-Nicklas und Kiran Musunuru wurde eine schnellstmögliche Verschränkung von Laborarbeit, klinischer Forschung und regulatorischer Prüfung erreicht.
Normalerweise braucht die Entwicklung und klinische Prüfung einer neuen Gentherapie Jahre, doch die Dringlichkeit von KJs Zustand erforderte eine Ausnahmeregelung. Vorausgegangen waren umfangreiche Vorarbeiten am IGI, die sogenannte „Cookbook“-Projekte zur Gestaltung und Herstellung von CRISPR-Therapien auf Nachfrage umfassten. Dies beinhaltete die Entwicklung sicherer und wirksamer Basiseditoren, die in der Lage sind, punktuelle DNA-Mutationen bei Patienten zu korrigieren. Der CPS1-Mangel von KJ war durch eine einzelne Basenpaarveränderung in seinem Genom bedingt. Diese präzise Mutation konnte durch die sogenannte Base-Editing-Technologie gezielt korrigiert werden, ohne die DNA komplett zu schneiden – ein entscheidender Vorteil im Hinblick auf die Sicherheit und Genauigkeit.
Die Therapie wurde via lipidbasierte Nanopartikel direkt in die Leberzellen verabreicht, da dieses Organ die fehlerhafte Proteinproduktion verantwortet. Diese Verabreichungsform ist aktuell eine der vielversprechendsten Methoden für die in vivo Gentherapie, da sie eine gezielte Lieferung des Editierwerkzeugs ermöglicht. Parallel zu der Entwicklung der Therapie wurde ein maßgeschneidertes Mausmodell geschaffen, damit die Wirksamkeit und Unbedenklichkeit der Behandlung vor der Anwendung am Patienten gründlich getestet werden konnten. Ein zentrales Element des schnellen Fortschritts war die nahtlose Zusammenarbeit zwischen akademischen Institutionen und industriellen Partnern. Unternehmen wie Integrated DNA Technologies, Aldevron und Acuitas Therapeutics unterstützten die Forschung durch die Herstellung klinisch geeigneter RNA-Moleküle, die in die Nanopartikel eingekapselt wurden.
Die Kommunikation zwischen den Teams war hoch effizient, was sich unter anderem an der raschen Bereitstellung eines spezifischen Mausmodells innerhalb von Minuten nach Anfrage zeigte. Ein weiteres essenzielles Element war die umfassende Sicherheitsprüfung, die speziell für KJ durchgeführt wurde. Mithilfe des INGENUITI-Projekts des IGI stand das Genom von KJ und dessen Vater in kurzer Zeit zur Verfügung, wodurch die Forscher eine exakt auf die individuelle Mutation abgestimmte Anleitung für den Base Editor entwerfen konnten. Zudem kam mit CHANGE-seq-BE eine ausgeklügelte Methode zum Einsatz, um mögliche unbeabsichtigte Veränderungen im Erbgut aufzudecken und zu bewerten. Das für die Sicherheitsanalysen benötigte Laborverfahren ist komplex und zeitintensiv, trotzdem wurde die gesamte Evaluierung innerhalb weniger Wochen abgeschlossen.
Das Ergebnis überzeugte die US-Arzneimittelbehörde FDA schnell genug, um den Behandlungsstart ohne größere Verzögerungen zu genehmigen. Die Behandlung von KJ begann etwa sechs Monate nach der ersten medizinischen Diagnose und erfolgte in mehreren Dosen. Die bisherigen Resultate sind vielversprechend: KJ zeigt keine ernsthaften Nebenwirkungen, sein Zustand hat sich verbessert, die Abhängigkeit von Medikamenten zur Ammoniak-Reduzierung hat abgenommen, und er wächst und gedeiht besser als erwartet. Zudem konnte er Infektionen ohne gefährliche Ammoniak-Anstiege überstehen, was bis dato lebensbedrohlich gewesen wäre. Dieser Erfolg ist nicht nur für KJ von großer Bedeutung, sondern für das gesamte Feld der Genmedizin und für Patienten mit seltenen, bislang nicht behandelbaren Krankheiten.
Das Projekt hat gezeigt, dass sich personalisierte CRISPR-Therapien nicht nur theoretisch, sondern praktisch binnen verblüffend kurzer Zeit realisieren lassen. Die Grundlage hierfür bilden jahrzehntelange Grundlagenforschung, gut koordinierte Teams und die Nutzung modernster genetischer Analyse- und Herstellungstechnologien. Die Entdeckung der CRISPR-Technologie begann als grundlagenwissenschaftliche Erforschung bakterieller Immunmechanismen gegen Viren. Heute, mehr als ein Jahrzehnt später, haben Pioniere wie Jennifer Doudna die Vision, diese Technologie denjenigen zugänglich zu machen, die sie am dringendsten benötigen. Die erfolgreiche Therapie von KJ zeigt, dass dieses Ziel greifbar nah ist.
Ausblick: Die Herausforderung für die Zukunft wird darin bestehen, die Prozesse zu skalieren und weitere Patienten mit individuellen genetischen Erkrankungen schnell und sicher behandeln zu können. Dies erfordert weiterhin intensive Zusammenarbeit zwischen Forschung, Klinik, Industrie und Regulierungsbehörden. Es gilt, die Modellierung, Herstellung und Zulassung solcher personalisierten Therapien zu optimieren, damit CRISPR-basierte Behandlungen nicht Einzelfällen vorbehalten bleiben, sondern breit verfügbar werden. Parallel dazu wird das wissenschaftliche Feld daran arbeiten, noch präzisere und sicherere Bearbeitungswerkzeuge zu entwickeln, die sich auf verschiedene Gewebe und Krankheitsbilder anwenden lassen. Das Potenzial der CRISPR-Technologie, genetische Erkrankungen zu heilen, eröffnet eine neue Ära der personalisierten Medizin, in der individuelle genetische Diagnosen unmittelbar in maßgeschneiderte Therapien übersetzt werden.
Zusammenfassend war die Behandlung von KJ ein historischer Erfolg, der nicht nur ein Kindleben rettete, sondern auch den Startschuss für eine transformative Phase in der Medizin darstellte. Die Kombination aus enormer wissenschaftlicher Expertise, technologischer Innovation und menschlichem Engagement macht Hoffnung für Millionen von Menschen, die heute noch keine Behandlung für ihre genetischen Erkrankungen haben. Die Zukunft der Genmedizin beginnt jetzt – schneller, persönlicher und effektiver als je zuvor.