Alzheimer zählt zu den größten Herausforderungen der modernen Medizin. Weltweit leiden Millionen Menschen an dieser fortschreitenden neurodegenerativen Erkrankung, die vor allem durch Gedächtnisverlust, kognitive Beeinträchtigungen und zunehmende Angstzustände gekennzeichnet ist. Die Komplexität der Krankheit hat Forschern lange Zeit Rätsel aufgegeben, doch dank innovativer Technologien steht die Alzheimer-Forschung an einem Wendepunkt. Besonders der Einsatz von Künstlicher Intelligenz (KI) ermöglicht tiefere Einblicke in bisher unbekannte Einflussfaktoren und eröffnet neue Chancen für die Entwicklung wirksamer Therapien. Forscher der University of California San Diego haben in einem bahnbrechenden Projekt eine bisher wenig beachtete Rolle des Gens PHGDH entdeckt, das bisher hauptsächlich als ein Biomarker galt.
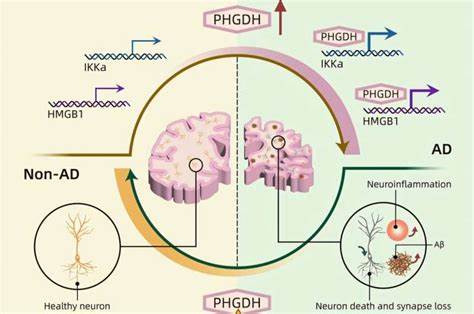
Sie konnten nachweisen, dass PHGDH mehr als nur ein Indikator ist; es nimmt eine kausale Rolle bei der Entstehung von Alzheimer ein. Dies gelang durch eine Kombination klassischer Forschungsansätze mit hochentwickelten KI-Methoden, die es erlaubten, das Molekül und seine Funktionen präziser als je zuvor zu untersuchen. PHGDH ist ein Gen, das für die Produktion eines Enzyms verantwortlich ist, das wiederum die Aminosäure Serin herstellt – ein wichtiger Baustein für den Körper und besonders das Gehirn. Lange Zeit ging man davon aus, dass die enzymatische Aktivität von PHGDH im Mittelpunkt seiner Wirkung steht. Doch die Wissenschaftler stießen auf ein „nebenberufliches“ Molekülverhalten – eine Moonlighting-Funktion –, bei der das Protein auch die Fähigkeit besitzt, direkt in die Regulation von Genaktivitäten einzugreifen.
Dies hat weitreichende Auswirkungen, da eine solche Störung die zelluläre Balance im Gehirn erheblich durcheinanderbringen kann. Durch den Einsatz von AI-gestützter dreidimensionaler Proteinstruktur-Analyse wurde entdeckt, dass PHGDH eine Untereinheit besitzt, die einer DNA-bindenden Domäne ähnelt, welche normalerweise nur bei Transkriptionsfaktoren vorkommt. Diese Erkenntnis ist bemerkenswert, da sie eine neue, bisher unerkannte Rolle des PHGDH-Gens enthüllt: es beeinflusst direkt, welche Gene im Gehirn ein- oder ausgeschaltet werden. Wenn diese Regulierung gestört ist, kann dies zu den ersten Anzeichen und Symptomen von Alzheimer führen. Diese Erkenntnisse stammen aus umfangreichen Studien mit genetisch veränderten Mäusen und menschlichen Gehirnorganiden, die die Auswirkungen variierender PHGDH-Expression verdeutlichen.
Erhöhte PHGDH-Spiegel waren mit einer stärkeren Ausprägung der Erkrankung verbunden, während eine Verringerung das Fortschreiten verlangsamte. Dies bestätigt PHGDH als kausalen Faktor für Alzheimer und nicht nur als Biomarker. Neben der Identifikation der Ursache stellt die Forschungsarbeit auch einen vielversprechenden therapeutischen Ansatz vor. Die meisten bisherigen Behandlungsmethoden zielen darauf ab, die Ansammlung von Beta-Amyloid-Plaques im Gehirn zu bekämpfen, die lange Zeit als Hauptursache für Alzheimer galten. Jüngste Studien, ebenso wie die vorgestellte Forschung, zeigen jedoch, dass dieses Vorgehen oft zu spät greift.
Die PHGDH-assoziierte Pathway liegt zeitlich davor und beeinflusst sogar die Entstehung der Amyloid-Plaques. Eine frühzeitige Intervention könnte somit effektiver sein. Eine Schlüsselentdeckung war die Nutzung eines kleinen Moleküls namens NCT-503, welches die Moonlighting-Funktion von PHGDH hemmt, ohne die enzymatische Aktivität zu stark zu beeinträchtigen. Dieser Unterschied ist wichtig, da die Serinproduktion nicht unnötig gestört werden darf. Die Forschungsgruppe konnte mit Hilfe von KI-Modellierungen zeigen, dass NCT-503 gezielt an die DNA-bindende Domäne des Proteins bindet und so dessen schädliche Genregulationsaktivität blockiert.
Die Effekte dieser Hemmung wurden Tierexperimenten bestätigt. Behandelte Mäuse zeigten eine signifikante Verbesserung in kognitiven Tests und reduzierten Angstverhalten – zwei der zentralen Symptome von Alzheimer. Auch wenn die Modelle nicht perfekt alle Aspekte der menschlichen Spontanform der Erkrankung abbilden können, gelten diese Resultate als vielversprechend und eröffnen die Tür für weitere präklinische Studien und die Entwicklung effektiver Therapien. Diese Fortschritte verdeutlichen die zukunftsweisende Rolle der Künstlichen Intelligenz in der biomedizinischen Forschung. Ohne die Fähigkeit der AI, komplexe Proteinkonformationen dreidimensional abzubilden und ähnliche Strukturen zu erkennen, wären diese wichtigen Einsichten wahrscheinlich unentdeckt geblieben.
Die Kombination traditioneller biomedizinischer Methoden mit AI-Technologien ermöglicht es, Moleküle auch auf sehr subtilen, multivariaten Ebenen zu analysieren und damit neue therapeutische Angriffspunkte zu definieren. Darüber hinaus bietet die therapeutische Nutzung von kleinen Molekülen wie NCT-503 praktische Vorteile gegenüber aktuellen Behandlungsmethoden. Während viele Alzheimer-Therapien auf intravenöse Infusionen angewiesen sind, die den Behandlungsalltag der Patienten erschweren und häufig mit Nebenwirkungen einhergehen, könnten oral verfügbare Mittel die Behandlung deutlich vereinfachen und patientenfreundlicher gestalten. Die Anwendung von Künstlicher Intelligenz eröffnet nicht nur neue Perspektiven für das Verständnis von Alzheimer, sondern weist auch den Weg hin zu personalisierten Behandlungskonzepten. Indem genetische Faktoren und ihre spezifischen Wirkungen besser erfasst werden, können Therapien gezielter entwickelt und eingesetzt werden.
Das Potenzial, Spontanfälle der Erkrankung frühzeitig zu erkennen und gezielt einzugreifen, kann wesentlich zur Verbesserung der Lebensqualität von Millionen Betroffenen beitragen. Zahlreiche Herausforderungen bleiben jedoch bestehen. Tiermodelle können derzeit die Komplexität der menschlichen Alzheimer-Erkrankung nur eingeschränkt abbilden. Die Übertragung der Erkenntnisse auf den Menschen erfordert umfangreiche klinische Studien und weitere Optimierung der Wirkstoffe. Die FDA-Zulassung und die Erprobung in kontrollierten Studien sind notwendig, bevor solche Ansätze zum klinischen Standard werden.
Nichtsdestotrotz stellt die Entdeckung der Moonlighting-Funktion von PHGDH und die Entwicklung eines passenden molekularen Hemmstoffs einen bedeutenden Schritt dar. Die Kombination aus biotechnologischer Innovation, Genforschung und Künstlicher Intelligenz bildet eine solide Grundlage für die weitere Forschung. Es wird erwartet, dass solche integrativen Ansätze auch bei anderen komplexen neurologischen Erkrankungen wichtige Fortschritte ermöglichen. Abschließend zeigt die Forschung eindrucksvoll, welche Rolle modernste Technologie in der Medizin einnimmt und wie sie die Tür zu neuen Behandlungsmöglichkeiten öffnet. Alzheimer, eine Erkrankung mit steigender Prävalenz und dramatischen gesellschaftlichen Auswirkungen, könnte in naher Zukunft durch gezielte therapeutische Ansätze besser kontrolliert und behandelt werden.
Die Integration von KI in die Alzheimer-Forschung beschleunigt die Entdeckung von Ursachen, das Verständnis molekularer Mechanismen und die Entwicklung effektiverer Therapien – ein Hoffnungsschimmer für Patienten, Angehörige und die gesamte medizinische Gemeinschaft.