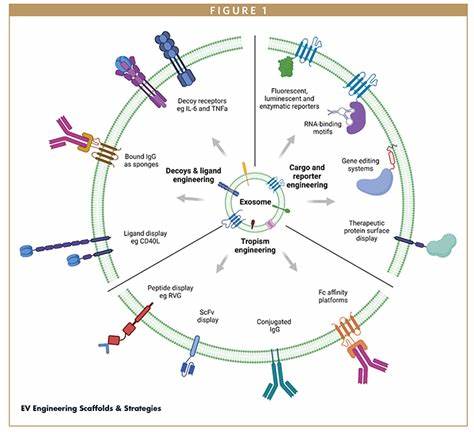
Extrazelluläre Vesikel (EVs) sind winzige Bläschen, die natürlicherweise von Zellen abgesondert werden und eine zentrale Rolle im interzellulären Informationsaustausch spielen. Sie transportieren wichtige biomolekulare Fracht, darunter Proteine, RNA und andere zelluläre Komponenten. Dank ihrer natürlichen Herkunft und biokompatiblen Eigenschaften besitzen EVs ein enormes Potenzial als Transportvehikel für moderne Medikamente. Die jüngsten wissenschaftlichen Durchbrüche, etwa jene der Forscher am Karolinska Institutet, haben es ermöglicht, diese Vesikel gezielt zu modifizieren und so die Wirksamkeit der Medikamentenabgabe sowohl in vitro als auch in vivo drastisch zu verbessern. Die verbesserte Technik nutzt genetisch bzw.
molekularbiologisch gezielte Veränderungen in extrazellulären Vesikeln, um therapeutische Proteine und Gen-Editing-Komplexe effizienter in Zielzellen zu schleusen. Zwei wichtige Bausteine spielen hierbei eine Schlüsselrolle: zum einen ein kleines Segment eines bakteriellen Proteins namens Intein, das die selbständige Freisetzung von therapeutischen Proteinen innerhalb der Zelle unterstützt, und zum anderen ein fusogenes Protein aus viralen Quellen. Dieses fusogene Protein erleichtert die Fusion der EVs mit der Endosomenmembran in der Zelle und sorgt so dafür, dass die therapeutische Fracht nicht im Abbauweg der Zelle verbleibt, sondern in den Zellkern oder das Zellplasma gelangen kann, wo sie ihre Wirkung entfaltet. Die Kombination beider Komponenten überwunden zentrale Barrieren, die bislang die Effizienz der intrazellulären Medikamentenfreisetzung durch EVs einschränkten. Das bedeutet einen großen Fortschritt in der Entwicklung neuer Therapiestrategien, vor allem im Bereich der Gentherapie und Proteintherapie.
Die Anwendung der Technologie erstreckt sich auf ein breites Spektrum von Erkrankungen. So lassen sich mit den modifizierten Vesikeln beispielsweise CRISPR/Cas9-Komplexe sicher in Zellen transportieren und dort gezielt Genkürzungen oder -änderungen vornehmen. Dies wurde im Rahmen von Tierversuchen eindrucksvoll demonstriert, bei denen Crem recombinase und Cas9-Systeme in die Gehirne von Mäusen eingebracht wurden. Durch die gezielte Lieferung konnten genetische Veränderungen in Bereichen wie dem Hippocampus und der Hirnrinde induziert werden. Diese Befunde eröffnen ganz neue therapeutische Möglichkeiten vor allem für neurodegenerative Erkrankungen wie Huntington oder spinaler Muskelatrophie, bei denen eine gezielte Genmanipulation bislang nur schwierig oder mit hohen Nebenwirkungen umsetzbar war.
Darüber hinaus zeigte die Technologie auch Wirksamkeit in Experimenten mit systemischer Entzündungshemmung. Die Fähigkeit, Proteine und RNA therapeutisch wirksam in Zellen einzubringen, bietet Perspektiven, um chronisch-entzündliche Erkrankungen, genetische Defekte und neurologische Störungen neu zu behandeln. Die biotechnologische Aufrüstung der extrazellulären Vesikel steht dabei im Einklang mit dem Wunsch nach möglichst biokompatiblen und minimal invasiven Therapieverfahren. Herkömmliche Methoden der Medikamentenlieferung stoßen oft an Grenzen, da die Wirkstoffe im Blut oder im Körper schnell abgebaut werden oder nicht ausreichend die Zielzellen erreichen. Die modifizierten EVs bieten durch ihre natürliche Zellkommunikation und Membraneigenschaften eine attraktive Alternative mit hoher Effizienz und Präzision.
Neben der Fusionsfähigkeit und Freisetzung mittels inteinvermittelter Spaltung zeichnen sich die EVs durch gute Verträglichkeit und niedrige Immunogenität aus, was die Gefahr von Abstoßungsreaktionen oder Entzündungen reduziert. Die Forschungsarbeit untermauert damit den wachsenden Trend, nanobiotechnologische Ansätze mit erweiterten molekularen Werkzeugen zu kombinieren, um so innovative Arzneimittelentwicklung zu fördern. Die Arbeit am Karolinska Institutet ist ein Beispiel auf diesem Gebiet: Durch die gezielte Kombination von viralen und bakteriellen Komponenten in EVs entsteht eine neuartige, multifunktionale Plattform für den therapeutischen Einsatz. Solche „intelligenten“ EVs könnten zukünftig die präzise Lieferung nicht nur von Medikamenten, sondern auch von komplexen biologischen Therapeutika wie Antikörpern, Enzymen oder RNA-basierten Molekülen übernehmen. Dabei wird erwartet, dass die Methode nicht nur für experimentelle, sondern auch für klinische Anwendungen skalierbar ist.
Wichtige Herausforderungen liegen dennoch weiterhin in der großtechnischen Produktion, Standardisierung der EV-Herstellung sowie in der detaillierten Untersuchung möglicher Nebenwirkungen oder Langzeitfolgen. Die Grundlagen dafür werden jedoch bereits intensiv erforscht. Im Kontext der personalisierten Medizin könnten solche Vesikel-basierte Therapiesysteme individualisiert auf den Patienten zugeschnitten werden, um etwa genetische Besonderheiten oder Erkrankungsstadien optimal zu adressieren. Auch die zielgerichtete Abgabe an bestimmte Gewebe oder Organe wird durch Anpassungen der EV-Oberfläche als Modifikationsmöglichkeit diskutiert. Im Vergleich zu klassischen Liposomen oder anderen Nanopartikeln bieten EVs zudem den Vorteil, dass sie von Zellen natürlicherweise als Transportvehikel genutzt werden, wodurch sie als besonders geeignet gelten, um Zellen nicht zu schädigen und dennoch komplexe Frachtmoleküle zu transportieren.
Der Erfolg der beschriebenen Technologie macht die Weiterentwicklung von EV-basierten Medikamentenplattformen zu einem der spannendsten Forschungsbereiche in der modernen Biomedizin. Nicht nur die Gentherapie, sondern auch die Behandlung von Krebs, Autoimmunerkrankungen, Stoffwechselkrankheiten sowie neurodegenerativen Leiden könnte von dieser Innovation profitieren. Die Zukunft könnte demnach von Therapien geprägt sein, die kleinste, natürliche Zellsignale nachahmen und so eine hochspezifische, schonende medikamentöse Wirkung erzielen. Die Kombination aus biotechnologischem Know-how, molekularer Präzision und naturbasierter Biokompatibilität hebt die extrazellulären Vesikel auf ein neues Level der medizinischen Anwendungsfähigkeit. In der Nähe klinischer Anwendung bieten diese Fortschritte Hoffnung für Millionen von Patientinnen und Patienten weltweit, deren Krankheiten bisher nur begrenzt behandelbar sind.
Zugleich verlangt diese Technologie interdisziplinäres Denken und Zusammenarbeit zwischen Molekularbiologen, Klinikern und Ingenieuren, um die vielversprechenden Erkenntnisse in sichere, effektive Therapien umzusetzen. Die in Nature Communications veröffentlichte Studie ist ein wichtiger Meilenstein auf diesem Weg. Sie zeigt, wie grundlegende Forschung in Verbindung mit innovativer Technik wirkliche Durchbrüche im Gesundheitswesen ermöglichen kann. Was vor wenigen Jahren noch Zukunftsmusik war, wird durch diese extrazellulären Vesikel bald zur klinischen Realität werden – ein echter Fortschritt für die moderne Medizin und die Lebensqualität der Menschen.