Mechanosensitive Gene sind essenzielle Schalter in Zellen, die auf mechanische Reize aus der Umgebung reagieren und so diverse zelluläre Prozesse steuern. Einen bislang wenig erforschten Bereich stellt die Wirkung von akustischen Wellen auf solche Gene dar. In jüngster Zeit wurden bemerkenswerte Fortschritte erzielt, die aufzeigen, wie Schall nicht nur als physikalische Kraft wirkt, sondern auch signifikante biologische Reaktionen auf zellulärer Ebene auslösen kann. Besonders spannend ist der Einfluss von Schall auf die Differenzierung von Adipozyten, also Fettzellen, was weitreichende Implikationen für Stoffwechselerkrankungen, regenerative Medizin und Gewebekultur haben könnte. Eukaryotische Zellen verfügen über komplexe Mechanosensoren, die Kräfte in ihrem Umfeld erkennen und in biochemische Signale übersetzen.
Traditionell erforscht man diese Reaktionen vor allem im Kontext von körperlicher Dehnung, Kompression oder Fluidströmungen. Doch mechanische Wellen aus dem hörbaren Schallbereich blieben weitgehend ungeachtet, obwohl Schall eine omnipräsente physikalische Kraft darstellt, die innerhalb des Körpers durch Knochen, Gewebe und Flüssigkeiten übertragen wird. Die Frequenzen hörbaren Schalls reichen von etwa 20 Hertz bis 20 Kilohertz, wobei in physiologischen Geweben Schallwellen mehrere Pascal bis Kilopascal Druck ausüben können. Innovative experimentelle Ansätze ermöglichten es Forschenden, Schallwellen gezielt und mit präziser Intensität auf Zellkulturen einzuwirken zu lassen. Ein speziell entwickeltes direktes Schalldruckgebungssystem nutzt Vibrationswandler, welche Schallwellen unmittelbar in die Kulturmedien übertragen, ohne dabei signifikante Erhitzung oder andere Nicht-Schall-Effekte zu verursachen.
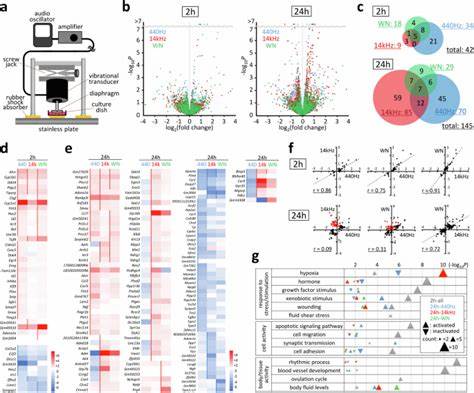
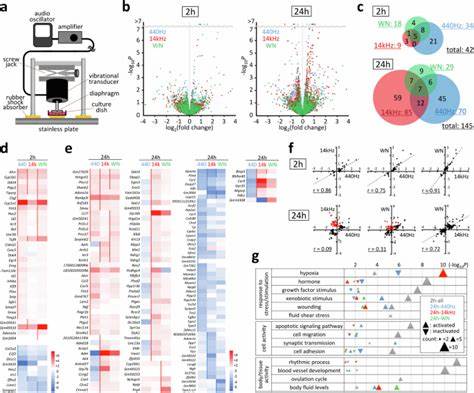
Studien mit der murinen C2C12 Myoblasten-Zelllinie zeigten bereits nach zwei Stunden akustischer Stimulation die Aktivierung von über 40 Genen, die den klanginduzierten Reaktionen zugeordnet werden können. Nach 24 Stunden stieg diese Zahl auf mehr als 140 an. Insbesondere das Gen Ptgs2, auch bekannt als Cyclooxygenase-2 (Cox-2), reagiert außergewöhnlich schnell auf Schallreize. Dieses Gen ist eminent wichtig für die Produktion von Prostaglandin E2 (PGE2), einem Molekül, das zahlreiche zelluläre Prozesse moduliert, einschließlich Entzündungsreaktionen und Differenzierungsmechanismen. Die Aktivierung von Ptgs2 geschieht unter Beteiligung des Focal Adhesion Kinase (FAK)-Signalwegs, einem Schlüsselmechanismus der Zelladhäsion und Mechanotransduktion.
Phosphorylierung von FAK an der Tyrosin-397-Stelle fördert die Stabilisierung von Fokalkontakten und verstärkt die Zelladhäsion, was gleichzeitig eine Umorganisation des Aktin-Zytoskeletts bewirkt. Die akustische Stimulation führte bei C2C12-Zellen zur Erweiterung der Zellfläche, verbunden mit verstärkter Lamellipodienbildung. Dadurch erhöht sich die Zellmigration und die Adhäsionsfähigkeit wird verbessert – Elemente, die für die Gewebeorganisation und Regeneration essenziell sind. Die unterschiedlichen Klangmuster wie reine Frequenzen bei 440 Hz, 14 kHz oder breitbandiges Weißes Rauschen induzierten dabei teilweise ähnliche, meist jedoch auch individuell ausgeprägte Genmuster und zelluläre Reaktionen, was auf komplexe Signalwege und Frequenz-spezifische Effekte hindeutet. Nicht nur Mechanismen auf genetischer Ebene, sondern auch aggregierte zelluläre Funktionen werden von Schallmodulation beeinflusst.
Die Forschungen zeigten, dass Schallwellen bei einer Intensität um 100 Pascal – vergleichbar mit physiologischen Bedingungen – die Umwandlung von Vorläuferzellen in ausdifferenzierte Adipozyten hemmen können. In Experimenten mit 3T3-L1 Präadipozyten wurden deutliche Rückgänge der Expression der adipogenen Marker Cebpa und Pparg beobachtet. Die Hemmung war umso stärker, je länger die akustische Stimulation andauerte bzw. je regelmäßiger sie erneut erfolgte. Die Hemmung der Adipozytendifferenzierung durch Schall dürfte vor allem über den PGE2-vermittelten Signalweg erfolgen.
Verschiedene Studien stützen die Rolle von Prostaglandin E2 als negativen Regulator der Adipozytendifferenzierung durch Bindung an den EP4-Rezeptor. Gleichzeitig wurde in den schallstimulierenden Kulturen eine erhöhte PGE2-Freisetzung gemessen, deren Ausstoß durch die Hemmung von FAK unterdrückt werden konnte. Dies verdeutlicht den kausalen Zusammenhang zwischen akustisch aktivierter Signaltransduktion und der konsekutiven Manifestation auf Genexpressions- und Differenzierungsebene. Die Forschung liefert auch wertvolle Erkenntnisse zur Zelltyp-spezifischen Empfindlichkeit gegenüber akustischer Stimulation. Während epitheliale Zelllinien und neuroblastomale Zellen verhältnismäßig geringe Reaktionen auf zeigten, erhielten adipogene Präzursorzellen und andere stromale Zelllinien erheblich stärkere Reaktionen auf FAK-Aktivierung, Ptgs2-Expression und PGE2-Ausschüttung.
Dies könnte mit der variierenden Struktur, Aktivität und Zusammensetzung der Fokalkontakte in unterschiedlichen Zelltypen zusammenhängen, die entscheidend für die Empfindlichkeit gegenüber mechanischen Reizen sind. Der Unterschied zwischen direkt erzeugten Schallwellen und indirekten Schallübertragungen, etwa durch Resonanzen oder Schwingungen von Kulturgefäßen, ist ebenfalls ein bedeutender Faktor. Direkt auf das Medium übertragener Schall ausgelöst durch Vibrationswandler ergab verstärkte Expressionsprofile von Mechanosensorgenen, während indirekt über Dish-Schwingungen übertragene Schallmuster teilweise dämpfende Effekte zeigten. Dies hebt die technische Bedeutung der Reizübermittlung hervor und legt nahe, dass exakte Steuerung und Messung von Schallparametern für biomedizinische Anwendungen notwendig sind. Eine wichtige Erkenntnis aus der Untersuchung akustischer Modulation ist die mögliche Ähnlichkeit mit anderen mechanischen Stimuli, wie etwa der Wirkung einer erhöhten Substratsteifigkeit, die bekanntermaßen die Differenzierung von Adipozyten negativ beeinflusst.
So könnte Schall unter physiologischen Bedingungen als eine Art mechanischer Umweltfaktor fungieren, der mit taktilem Feedback der extrazellulären Matrix konkurriert oder diese ergänzt. Die mechanosensible Signalkaskade, ausgelöst durch FAK, Ptgs2 und PGE2, zeigt dabei Analogien zu bekannten Wechselwirkungen zwischen Zellen und ihrer mechanischen Umgebung. Dies erweitert das Verständnis mechanotransduktiver Prozesse und stellt die akustische Welle als bislang unterschätzten Stimulus vor. Während Frequenzen im MHz-Bereich (etwa bei low-intensity pulsed ultrasound) vielfach medizinisch technisch genutzt werden, eröffnen die Ergebnisse der akustischen Modulation im hörbaren Bereich neue Möglichkeiten des gezielten Zellstimulus ohne invasive Techniken. Die Anwendungsmöglichkeiten reichen von der Erzeugung optimierter Umgebungen für die Gewebekultur und regenerative Medizin über therapeutische Interventionen bei Stoffwechselerkrankungen bis hin zur fundamentalen Erforschung der lebenden Zellmechanik.
Es ist durchaus denkbar, dass zukünftige Therapiekonzepte auf sanften akustischen Stimuli basieren, um Zellfunktionen gezielt zu modulieren, ohne störende oder schädliche physikalische Nebenwirkungen. Zusammenfassend zeigen aktuelle Forschungsergebnisse eine klare Verbindung zwischen akustischer Stimulation und der Regulation mechanosensitiver Gene wie Ptgs2 und Ctgf, sowie ihre Folgen für die Adipozytendifferenzierung. Die Entdeckung, dass Schall keine rein physikalische Größe bleibt, sondern biologische Signalwege direkt beeinflusst, stellt einen bedeutenden Fortschritt in der Zellbiologie dar. Sie fordert bislang konventionelle Sichtweisen heraus und eröffnet ein neues interdisziplinäres Feld zwischen Akustik, Zellmechanik und Biomedizin. Zukünftige Arbeiten werden sich darauf konzentrieren, die molekularen Mechanismen der akustischen Signaltransduktion weiter zu entschlüsseln, Unterschiede zwischen Zelltypen auszuleuchten sowie den Einfluss variierender Frequenzen, Intensitäten und Zeitmuster der akustischen Stimulation systematisch zu untersuchen.