Krebs zählt weltweit weiterhin zu den größten Gesundheitsproblemen und fordert Millionen von Menschenleben jährlich. Traditionelle Therapien wie Chemotherapie, Strahlentherapie und Chirurgie sind zwar effektiv, aber häufig mit Nebenwirkungen und Resistenzen verbunden. Eine vielversprechende neue Richtung in der Krebsbehandlung setzt an der metabolischen Besonderheit von Tumoren an, nämlich ihrer erhöhten und spezifischen Nährstoffaufnahme und -verwertung. Aktuelle Forschungsergebnisse zeigen, dass die Implantation von sogenannten „engineered“ (genetisch modifizierten) Adipozyten, also Fettzellen, das Tumorwachstum in Krebsmodellen signifikant hemmen kann. Dieser innovative Therapieansatz nutzt die Fähigkeit von Adipozyten, über den Stoffwechsel mit Tumorzellen zu konkurrieren und somit deren Versorgung mit lebenswichtigen Substraten wie Glukose und Fettsäuren einzuschränken.
Die Methode wurde unter dem Begriff „adipose manipulation transplantation“ (AMT) zusammengefasst und stellt eine neuartige zellbasierte Krebstherapie dar. Tumoren zeichnen sich durch eine erhöhte Aufnahme von Glukose und Fettsäuren aus, um ihr rapides Wachstum zu fördern. Dieses Phänomen ist als Warburg-Effekt bekannt, bei dem Krebszellen trotz vorhandener Sauerstoffversorgung auf Glykolyse als Hauptenergiequelle setzen. Gleichzeitig können Tumore unter Sauerstoffmangel verstärkt Fettsäuren als Energiequelle nutzen, was den Energieertrag gegenüber Glukose steigert. Die metabolische Flexibilität der Krebszellen stellt eine Herausforderung für gezielte Therapien dar.
Bisherige druggestützte Ansätze konzentriert auf die Hemmung von Glykolyse- oder Fettstoffwechselwegen stoßen oft wegen der Variabilität der Tumormetabolismen und Nebenwirkungen an ihre Grenzen. Die Idee, Adipozyten modifiziert einzusetzen, beruht auf zwei zentralen Eigenschaften des Fettgewebes. Zum einen ist es klinisch einfach zugänglich und bereits etablierter Gegenstand verschiedener chirurgischer Verfahren wie Liposuktion und autologer Fetttransplantation. Zum anderen besitzen weiße Adipozyten (WAT) die Fähigkeit, durch genetische und epigenetische Modifikation in beige/braune Adipozyten beigemischt zu werden, die eine thermogenetisch aktive Funktion ausüben und den Glukose- und Fettstoffwechsel intensivieren. Diese Umwandlung wird als „Browning“ bezeichnet und erhöht den Energieverbrauch deutlich.
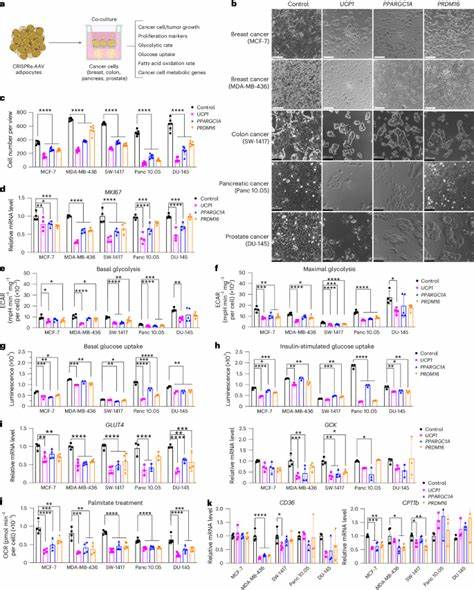
Wissenschaftler nutzen moderne Technologien wie die CRISPRa-Technologie (CRISPR-aktivierung), um in humanen weißen Adipozyten spezifische Gene zu aktivieren, die für diese Browning-Phase essenziell sind. Dazu gehören beispielsweise das Gen für „uncoupling protein 1“ (UCP1), das den Protonenfluss in Mitochondrien reguliert und Wärmeproduktion initiiert, sowie Transkriptionsfaktoren wie PPARGC1A und PRDM16, die die braune Fettzell-Identität fördern. Durch die Hochregulierung dieser Gene wird der Stoffwechsel der Adipozyten so beeinflusst, dass sie in der Lage sind, Glukose und Fettsäuren in deutlich erhöhtem Maße aufzunehmen und zu verstoffwechseln. In vitro Experimente zeigten, dass diese genetisch modifizierten Adipozyten in Co-Kulturen mit verschiedenen Krebszelllinien aus Brust-, Darm-, Pankreas- und Prostatakrebs das Zellwachstum der Tumorzellen maßgeblich reduzierten. Die Krebszellen litten unter verringerter Glukoseaufnahme, abgeschwächter Glykolyse und vermindertem Fettsäureoxidationspotential.
Dadurch wurde ihre Teilungsaktivität signifikant herabgesetzt, was durch die reduzierte Expression von Proliferationsmarkern wie MKI67 bestätigt wurde. Auch in vivo konnte die Wirkung der AMT nachgewiesen werden. In xenograft-Mausmodellen, bei denen menschliche Tumorzellen zusammen mit den modifizierten Adipozyten implantiert wurden, trat ein deutlicher Rückgang der Tumorgröße auf. Die Tumorstadien wiesen weniger Hypoxie und geringere Angiogenese auf, was auf eine erniedrigte Versorgung mit Sauerstoff und Nährstoffen zurückzuführen ist. Die apoptotische Aktivität der Tumorzellen nahm zu, was auf den gewünschten therapeutischen Effekt hinweist.
Eine besondere Stärke des AMT-Ansatzes ist die Flexibilität seiner Anwendung. Die Adipozyten oder adipösen Organoide können durch verschiedene Aktivierungsmethoden kontrolliert werden, etwa durch den Einsatz von Tet-On-Systemen, welche die Genexpression mittels eines Doxycyclin-induzierbaren Mechanismus regulierbar machen. Auch eine Implantation in ein biokompatibles Zelltragsystem (Scaffold) wurde entwickelt, das die Stabilität der Transplantate erhöht und eine Entfernung oder den Austausch der implantierten Zellen ermöglicht, falls dies klinisch erforderlich wird. Nicht nur Glukose- und Fettsäurestoffwechsel, sondern auch andere tumorrelevante metabolische Wege können mit AMT beeinflusst werden. Ein Beispiel ist die gezielte Hochregulation des Enzyms Uridinphosphorylase 1 (UPP1) in Adipozyten, wodurch uridinabhängige Adenokarzinome der Bauchspeicheldrüse metabolisch konkurrenziert und das Tumorwachstum somit reduziert werden konnten.
Diese Anpassungsfähigkeit eröffnet weitere Anwendungsfelder und personalisierte Therapieoptionen. Ein zusätzlicher Nutzen der modifizierten adipösen Organoide ist ihr positiver Einfluss auf den Gesamtstoffwechsel des Organismus. Studien zeigten eine erhöhte Sauerstoffaufnahme, verbesserte Glukosetoleranz und gesteigerte Insulinsensitivität in behandelten Mäusen. Die systemische Senkung des Insulinspiegels, eines bekannten Wachstumsfaktors für Krebszellen, könnte ebenfalls zur Tumorsuppression beitragen. Interessanterweise ließ sich durch Fütterung mit kalorienreichen Diäten oder glukosereichen Getränken dieser hemmende Effekt auf Tumorwachstum verhindern, was die Bedeutung der metabolischen Konkurrenz bestätigt.
Die Verwendung adipöser Zellen aus patienteneigenem Gewebe bietet zudem den Vorteil der autologen Transplantation mit geringem Risiko einer Immunreaktion. Besonders für die Behandlung von Brustkrebs ergeben sich praktische Vorteile, da nach Mastektomien oft autologe Fetttransplantationen im Rahmen der Rekonstruktionschirurgie erfolgen. Die Vorbereitung und Modifikation der fettleibigen Zellen ex vivo ermöglicht eine gezielte Optimierung der gewünschten Eigenschaften vor der Reimplantation. Trotz der vielversprechenden Ergebnisse bestehen Herausforderungen. Das Risiko der krebsassoziierten Kachexie sollte sorgfältig evaluiert werden, da braunes Fettgewebe mit erhöhtem Energieverbrauch auch einen potenziellen Gewichtsverlust begünstigen kann.
Die Entwicklung kontrollierbarer Systeme und biokompatibler Implantate zur gezielten Aktivierung und evtl. Entfernung der transplantierten Zellen stellt deswegen eine wichtige Sicherheitsmaßnahme dar. Zusammenfassend beschreibt die Implantation genetisch modifizierter adipöser Zellen eine neuartige, vielversprechende Strategie im Kampf gegen Krebs. Durch die Ausnutzung der metabolischen Bedürfnisse von Tumoren und den Einsatz modifizierter Fettzellen als metabolische Konkurrenten konnte in verschiedensten Krebsmodellen eine effektive Tumorsuppression erreicht werden. Die Kombination modernster Genomeditierungstechnologien mit bewährten chirurgischen Verfahren macht diese Therapieform sowohl innovativ als auch klinisch vielversprechend.
Zukünftige Forschung wird darauf abzielen, die Langzeitwirkung, optimale Dosierung und Kombination mit bestehenden Therapien zu klären, um den Weg für die Anwendung beim Menschen zu ebnen. Diese Entwicklung steht beispielhaft für den Trend hin zu personalisierten und zellbasierten Krebstherapien, die über die direkte Bekämpfung der Tumorzellen hinausgehen und das gesamte metabolische Umfeld gezielt beeinflussen.