Zellulose zählt zu den häufigsten organischen Polymere auf der Erde und stellt eine zentrale Ressource für die Herstellung nachhaltiger Biokraftstoffe und Biochemikalien dar. Trotz ihrer einfachen chemischen Zusammensetzung aus Glukoseeinheiten ist die enzymatische Umwandlung von Zellulose äußerst komplex, da die kristalline Struktur und die verketteten Interaktionen mit anderen Pflanzenzellwandbestandteilen die Zugänglichkeit schwierig machen. Diese natürliche Resistenz der Biomasse, auch als Biomasse-Rezistenz bezeichnet, stellt eine große Herausforderung für die effiziente Nutzung von pflanzlichem Abfallmaterial dar. Im Rahmen neuester Forschung wurde ein bisher unbekanntes Enzym identifiziert, das aus dem genetischen 'dunklen Bereich' von Mikroorganismen stammt, die in einem spezialisierten Ökosystem leben, das pflanzliche Biomasse abbaut. Die Forschung erfolgte durch die Nutzung metagenomischer Analysen, bei denen genetisches Material direkt aus Umweltproben entnommen wird, ohne dass Mikroorganismen im Labor kultiviert werden müssen.
Dabei wurde dieser bislang unerforschte Bereich genetischer Information, auch als metagenomische Dunkle Materie bezeichnet, systematisch untersucht, um neue biokatalytische Funktionen zu finden. Das neu entdeckte Enzym zeichnet sich dadurch aus, dass es eine oxidative Spaltung von Zellulose katalysiert, anstatt wie traditionelle Zellulasen hydrolytisch zu wirken. Es handelt sich um eine metalloenzymatische Reaktion, bei der Kupfer im aktiven Zentrum eine zentrale Rolle spielt. Interessant ist hierbei, dass das Enzym durch eine exo-Mechanik arbeitet und gezielt die C1-Position der Zellulosekette oxidiert, was zur Bildung von ausschließlich Cellobionsäure führt. Diese selektive Regioselektivität und der oxidative Mechanismus unterscheiden das Enzym grundlegend von den bisher bekannten Zellulose-abbauenden Enzymen.
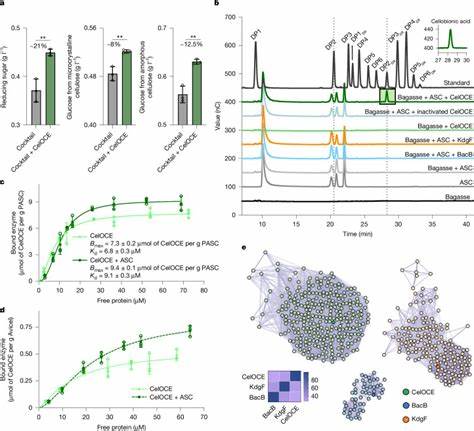
Kristallstrukturanalysen dieses Enzyms enthüllten eine kompakte Ähnlichkeit zu sogenannten Jelly-Roll-Faltungen mit eingebettetem Kupferkatalysezentrum. Ein markantes Merkmal ist die homodimere Konfiguration, die eine gleichzeitige Erzeugung von Wasserstoffperoxid durch eine Untereinheit ermöglicht, während die andere aktiv mit dem Zellulose-Substrat interagiert. Dieses in situ erzeugte Wasserstoffperoxid fungiert als unverzichtbares Co-Substrat für die oxidative Spaltung, was die Effizienz der Reaktion steigert und zugleich mögliche Nebenreaktionen minimiert. Der metagenomische Ursprung des Enzyms liegt in Bodenproben, die über Jahrzehnte mit Zuckerrohr-Bagasse bedeckt waren. In diesem spezialisierten Mikrobiom zeigt sich eine deutlich reduzierte mikrobielle Vielfalt zugunsten von Taxa, welche lignozelluloseabbauende Fähigkeiten besitzen.
Diese ökologische Spezialisierung begünstigte die Identifikation zahlreicher Gene mit potenzieller Bedeutung für den pflanzlichen Biomasseabbau, wozu auch das neu entdeckte oxidierende Zellulose-Enzym gehört. Biochemische Untersuchungen bestätigten die starke Affinität des Enzyms zu komplexer Zellulose, wobei Bindungstests zeigten, dass es selbst unter konkurrierenden Bedingungen an das Substrat bindet. Zudem wurde keine hydrolytische Aktivität an typischen Zellulosebestandteilen oder anderen Polysacchariden beobachtet, was die Einzigartigkeit seiner katalytischen Funktion unterstreicht. Die exklusive Freisetzung von Cellobionsäure wurde sowohl mittels hochleistungsfähiger chromatographischer Methoden als auch durch Massenspektrometrie eindeutig nachgewiesen. Diese neue Art von Kupfer-Metalloenzym stellt damit eine bedeutende Erweiterung des Wissens über enzymatische Redoxmechanismen im pflanzlichen Biomasseabbau dar.
Die bisherigen Modelle, welche hauptsächlich auf hydrolytischen Enzymen und lytischen Polysaccharid-Monooxygenasen (LPMOs) basieren, müssen vor dem Hintergrund dieser Entdeckung erweitert werden. Die Funktionsweise des Enzyms ist zudem nicht ausschließlich von exogenen Wasserstoffperoxidspenden abhängig, da die Eigenproduktion innerhalb des Homodimers eine autonome Aktivität ermöglicht. Diese Eigenschaft könnte in industriellen Anwendungen die Prozessökonomie und -stabilität verbessern. Die praktische Relevanz dieser Erkenntnis zeigte sich in Experimenten, bei denen ein herkömmliches Enzymcocktail, basierend auf Trichoderma reesei, mit dem neu entdeckten Enzym ergänzt wurde. Die Kombination führte zu einer signifikanten Steigerung der Glukosefreisetzung aus vorbehandelter lignozellulosehaltiger Biomasse.
Die Verbesserung lag bei über 20 Prozent, was in Bezug auf Effizienzsteigerungen in Industriemaßstäben erheblich ist. Zudem konnte das modifizierte Enzymgemisch unter Bedingungen mit hohem Feststoffanteil in Pilotanlagenskala produziert und eingesetzt werden, was seine praktische Umsetzbarkeit demonstriert. Die evolutionäre Verbreitung von CelOCE-Homologen wurde durch bioinformatische Analysen überprüft. Die orthologen Sequenzen finden sich in einer Vielzahl von bakteriellen und archaischen Taxa, die mit dem Abbau von pflanzlicher Biomasse in Verbindung stehen. Dies weist auf eine weitreichende Bedeutung und Diversität dieses Enzymtyps in natürlichen Ökosystemen hin.
Die innovative Struktur-Funktions-Beziehung und der oxidative Mechanismus des Enzyms eröffnen zudem neue Möglichkeiten für die Proteinmodifikation und synthetische Biologie. Aufgrund seines vergleichsweise kleinen Molekulargewichts und der einfachen, dennoch effektiven Kupferkoordination, eignet sich das Molekül gut für gezielte Engineering-Ansätze mit dem Ziel der weiteren Funktionsoptimierung oder Anpassung für spezifische industrielle Prozesse. Zusammenfassend markiert die Entdeckung und Charakterisierung dieses metagenomischen 'Dunkle Materie'-Enzyms einen Durchbruch im Bereich der Enzymologie pflanzlicher Biomasse. Sie erweitert nicht nur fundamentales Wissen über mikrobielle Abbaumechanismen, sondern trägt auch maßgeblich zur Entwicklung nachhaltiger biobasierter Technologien bei. Die Fähigkeit dieses Kupfer-Metalloenzyms, Pflanzenzellulose effizient oxidativ aufzubrechen und mit klassischen Zellulasen synergistisch zu wirken, tritt als vielversprechender Baustein für die zukünftige Bioökonomie hervor.
Vor dem Hintergrund der globalen Bemühungen um CO2-Reduktion und Ressourcenschonung spielt die Nutzung von agrowirtschaftlichen Reststoffen eine zentrale Rolle. Enzyme mit neuen Wirkmechanismen wie das hier beschriebene CelOCE können entscheidend dazu beitragen, die Umwandlung dieser nachwachsenden Rohstoffe wirtschaftlich rentabel und technologisch effektiv zu gestalten. Insofern ist diese Forschung nicht nur ein Meilenstein in der Wissenschaft, sondern besitzt weitreichende Implikationen für Industrie, Umwelt und Gesellschaft.