Krebs stellt nach wie vor eine der größten Herausforderungen in der modernen Medizin dar. Traditionelle Behandlungsmethoden wie Chemotherapie, Strahlentherapie oder chirurgische Eingriffe stoßen bei vielen Tumorarten an ihre Grenzen, insbesondere wenn es um Fortschreiten und Metastasierung geht. Aus diesem Grund gewinnt die Erforschung neuer therapeutischer Ansätze immer mehr an Bedeutung. Eine besonders innovative Methode ist die Implantation von genetisch oder molekular technisch modifizierten Fettzellen, den sogenannten Adipozyten, um das Tumorwachstum zu hemmen. Diese Form der Therapie verspricht, durch metabolische Konkurrenz den Tumorzellen lebenswichtige Nährstoffe zu entziehen und damit ihre Proliferation zu bremsen.
Tumoren zeichnen sich durch ihren erhöhten Stoffwechselbedarf aus. Um das schnelle Wachstum und die Vermehrung zu gewährleisten, benötigen sie große Mengen an Glukose und Fettsäuren. Die meisten Krebszellen zeigen dabei eine verstärkte Glykolyse, auch bekannt als Warburg-Effekt – eine Stoffwechselumstellung, bei der trotz vorhandenen Sauerstoffs vermehrt Glukose in Lactat umgewandelt wird. Darüber hinaus passen sich Tumorzellen oft an hypoxische (sauerstoffarme) Bedingungen an und erhöhen die Aufnahme und Nutzung von Fettsäuren als Energiequelle, da diese eine höhere Energiedichte aufweisen als Glukose. Vor diesem Hintergrund eröffnet die Anpassung und Implantation von Adipozyten, die metabolisch gegenüber Tumorzellen konkurrenzfähig sind, einen revolutionären Therapieansatz.
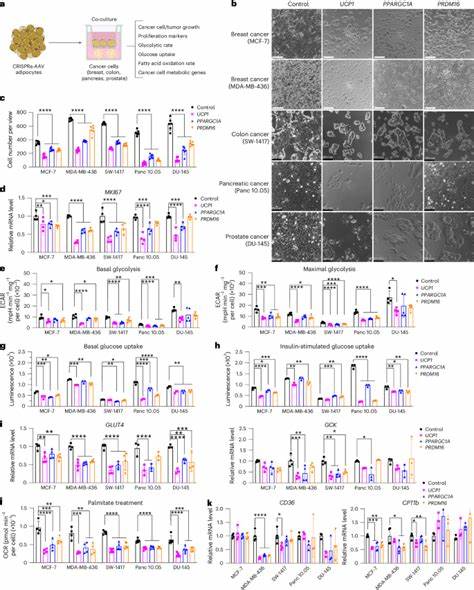
Wissenschaftler haben Methoden entwickelt, bei denen weiße Fettzellen (White Adipose Tissue, WAT) in einen braunen oder beigeähnlichen Zustand umprogrammiert werden. Braune Fettzellen besitzen die Fähigkeit, Energie in Form von Wärme zu dissipieren statt in Adenosintriphosphat (ATP) zu speichern, was mit einer erhöhten Glukose- und Fettsäureaufnahme und -verbrennung einhergeht. Diese sogenannte „Browning“ der Fettzellen macht sie zu effektiven Konkurrenten der Tumorzellen. Durch den Einsatz von CRISPR-Activation-Technologie (CRISPRa) gelingt es, Schlüsselgene wie UCP1 (Uncoupling Protein 1), PPARGC1A oder PRDM16 hochzuregulieren, die für den braunen Fettcharakter essenziell sind. Modifizierte Adipozyten zeigen dadurch eine gesteigerte Sauerstoffverbrauchsrate, erhöhte Glukose- und Fettsäureaufnahme sowie eine intensivere Fettsäureoxidation.
In Zellkulturmodellen führt die Co-Kultivierung von diesen „braunisierten“ Adipozyten mit verschiedenen Krebszelllinien – darunter Brust-, Darm-, Pankreas- und Prostatakarzinome – zu einer signifikanten Reduktion der Zellzahl und der Proliferationsrate der Krebszellen. Gleichzeitig bedingt der gesteigerte Stoffwechsel der Adipozyten einen niedrigen Glukose- und Fettsäurevorrat für die Tumorzellen, was deren Wachstum stark einschränkt. In präklinischen Tiermodellen, speziell in immunsupprimierten Mäusen mit Tumorxenotransplantaten, konnten implantierte modifizierte Adipozytenorganoide benachbart zum Tumor zu einer deutlichen Verringerung der Tumorgröße führen. Interessanterweise zeigen die Tiere keine signifikanten Nebenwirkungen wie Gewichtsverlust oder allgemeine Schwäche – ein wichtiges Kriterium bei der Entwicklung neuer Therapien. Neben der Tumorverkleinerung konnten Untersuchungen eine verringerte Angiogenese (Bildung neuer Blutgefäße im Tumor) und reduzierte Hypoxie nachweisen.
Beide Faktoren korrelieren häufig mit einer aggressiven Tumorentwicklung und schlechter Prognose. Eine weitere faszinierende Erkenntnis ist, dass die Wirkung der implantierten Adipozyten nicht nur lokal am Tumorort, sondern auch systemisch auftreten kann. So führte die Implantation von braunisierten Adipozyten in einem distalen Gewebe, beispielsweise am Rücken der Tiere, dennoch zur Hemmung des Tumorwachstums im Brustkrebsmodell. Dies unterstreicht die Möglichkeit, dass die modifizierten Fettzellen durch den erhöhten Grundumsatz und der verbesserten Regulierung des gesamten Energiestoffwechsels den metabolischen Zustand des Wirts verbessern und dadurch indirekt das Tumorwachstum beeinflussen. Bezüglich des Stoffwechselmechanismus wurde klar, dass die Effektivität der Krebshemmung bei einer erhöhten Nahrungszufuhr, insbesondere Zufuhr von Glukose oder fettreichen Diäten, deutlich abnimmt.
Dies legt nahe, dass der Wettbewerb um Glukose und Fettsäuren ein zentraler Bestandteil des Wirkprinzips ist. Solche Erkenntnisse bestätigen nicht nur die metabolische Essenz der Therapie, sondern liefern auch wichtige Hinweise zur Kombination mit Ernährungsstrategien bei der Behandlung. Zudem zeigte sich, dass die Adipozytentechnologie unterschiedlich modifiziert werden kann, um andere stoffwechselbedingte Pfade von bestimmten Tumoren zu adressieren. Beispielhaft wurde durch das Hochregulieren von Uridinphosphorylase 1 (UPP1) bei modifizierten Adipozyten ein uridinabhängiges Pankreaskarzinom erfolgreich im Wachstum gehemmt, indem die modifizierten Zellen konkurrierend den limitierenden Nährstoff Uridin aufnahmen. Diese Flexibilität macht den Ansatz besonders attraktiv für die personalisierte Therapie in der Onkologie.
Neben der biologischen Effektivität bietet die Technik weitere Vorteile, die ihrer klinischen Anwendung entgegenkommen. So können Adipozyten relativ einfach durch Liposuktion gewonnen werden, was einen minimalinvasiven Eingriff darstellt und in der plastischen Chirurgie schon Routinemethode ist. Dies ermöglicht theoretisch eine autologe Behandlung, bei der Patienteneigene Fettzellen entnommen, ex vivo genetisch modifiziert und danach zurückimplantiert werden. Die geringere Immunogenität von Adipozyten im Unterschied zu Immunzellen wie T-Zellen erleichtert zudem die Entwicklung von zellbasierten Therapien ohne starke Immunreaktionen. Die Kombination mit innovativen Auslieferungssystemen, etwa biokompatiblen Zellträger- oder Scaffoldstrukturen, erlaubt es zudem, die implantierten Adipozyten gezielt am Tumor zu positionieren und bei Bedarf wieder zu entfernen oder auszutauschen.
Ferner ermöglichen induzierbare Systeme, die über Medikamente wie Tetracyclin reguliert werden, eine temporäre Aktivierung oder Deaktivierung der Genmodulation, wodurch eine flexible und kontrollierbare Behandlung möglich wird. Obwohl erste Studienergebnisse vielversprechend sind, müssen noch mehrere Herausforderungen gemeistert werden, bevor die Implantation modifizierter Adipozyten als Krebsbehandlung breit eingesetzt werden kann. Die Langzeitwirkung und Sicherheit, mögliche Effekte auf das gesamte Energiestoffwechselgleichgewicht des Körpers sowie das Risiko einer potenziellen Kachexie (starker Körpergewichts- und Fettmasseverlust bei Krebserkrankungen) müssen gründlich erforscht werden. Dennoch bieten die derzeitigen Erkenntnisse eine solide Grundlage, um diesen neuartigen Therapieansatz weiterzuentwickeln und in klinischen Studien zu testen. Die Forschung rund um die AMT (Adipose Manipulation Transplantation) kann zukünftig zudem auf die Kombination mit bestehenden Therapien abzielen.