Krebs bleibt eine der weltweit größten gesundheitlichen Herausforderungen, trotz erheblicher Fortschritte in Diagnostik und Therapie. Die Suche nach innovativen Behandlungsmöglichkeiten führt immer mehr in den Bereich der metabolischen Manipulation der Tumorumgebung. Eine faszinierende und neue Methode ist die Nutzung von sorgfältig genetisch modifizierten Adipozyten – den Fettzellen unseres Körpers – um Krebszellen die lebensnotwendigen Nährstoffe zu entziehen und ihr Wachstum zu hemmen. Diese Strategie könnte das therapeutische Arsenal gegen Tumore bedeutend erweitern und maßgeschneiderte Behandlungsmöglichkeiten bieten. Tumorzellen zeichnen sich durch erhöhten Energie- und Nährstoffbedarf aus.
Sie verbrauchen Glukose intensiv, wandeln sie bevorzugt durch anaerobe Glykolyse – den sogenannten Warburg-Effekt – in Energie um, selbst bei Sauerstoffverfügbarkeit. Zusätzlich reprogrammmieren sie ihren Stoffwechsel um vermehrt Fettsäuren zur Energiegewinnung zu nutzen, ein Mechanismus, der vor allem in sauerstoffarmen Tumormikroumgebungen vorteilhaft ist. Diese metabolische Flexibilität macht Krebszellen zu anspruchsvollen Konkurrenten im Nährstoffwettstreit innerhalb des Tumormilieus. Hier setzen fingierte Adipozyten an. Diese Zellen, die normalerweise Fett speichern, können gentechnisch mit Hilfe von CRISPRa-Technologie so umprogrammiert werden, dass sie Energieträger wie Glukose und Fettsäuren überdurchschnittlich stark aufnehmen und verstoffwechseln.
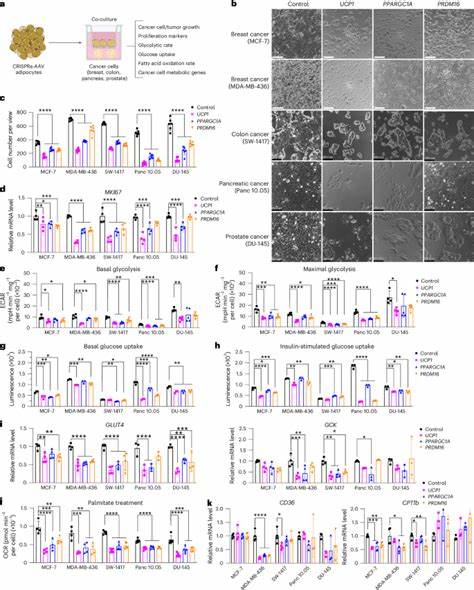
Insbesondere die Überexpression von UCP1, einem Protein, das für die „Browning“ von Fettzellen – also die Umwandlung weißer Fettzellen in sogenannte beige oder braune Fettzellen – verantwortlich ist, steigert die metabolische Aktivität signifikant. Diese braunen Fettzellen sind für Wärmeproduktion verantwortlich und verbrauchen Energie, anstatt sie zu speichern. Die genetisch modifizierten Adipozyten konkurrieren durch erhöhte Aufnahme mit den Tumorzellen um lebenswichtige Nährstoffe und schwächen so deren Wachstumsfähigkeit entscheidend. Studien zeigen, dass die neben Tumorzellen implantierten modifizierten Adipozyten in verschiedenen Modellen – darunter Brust-, Pankreas-, Kolon- und Prostatakrebs – das Tumorwachstum drastisch reduzieren. Sowohl in vitro in Co-Kultur-Systemen als auch in vivo in xenotransplantierten Mäusen verringert sich die Proliferation der Krebszellen deutlich.
Dies zeigt sich durch verminderte Zellzahlen, reduzierte Expression von Proliferationsmarkern wie MKI67 und Abnahme von metabolischen Kennzahlen der Tumorzellen, darunter Glukoseaufnahme und Fettsäureoxidation. Gleichzeitig nimmt die Sauerstoffverbrauchsrate der Ingenieur-Adipozyten deutlich zu – ein Indiz für ihre gesteigerte Stoffwechselaktivität. Dies führt zu einer nutritiven Benachteiligung der Tumorzellen, welche ihre Ressourcen nicht mehr ausreichend zur Energiegewinnung nutzen können. Die Technik, bekannt als adipose manipulation transplantation (AMT), beweist zudem ein hohes Anpassungspotential: Neben der Modulation von UCP1 sind weitere Gene wie PPARGC1A und PRDM16 möglich, die ebenfalls für braunes Fett charakteristisch sind. Noch flexibler wird diese Methode durch die Anwendung einer inducible (ansteuerbaren) CRISPRa-Technologie, mit der z.
B. durch Tetracyclin-Gabe die Aktivierung der Modifikation je nach Bedarf ein- und ausgeschaltet werden kann. Außerdem ermöglichen innovative bioengineering-basierte Implantationsplattformen, etwa Mikrowellengerüste aus Polycaprolacton, die kontrollierte und wieder entfernbare Verabreichung der Adipozyten im Körper. Ein weiterer spannender Aspekt ist das Potenzial der personalisierten Medizin. Untersuchungen mit adipösen Zellen aus dem Brustgewebe von Krebspatienten oder Hochrisikopatienten mit genetischer Prädisposition zeigen, dass auch autologe (körpereigene) adipöse Zellen erfolgreich gentechnisch manipuliert und implantiert werden können.
Patientenindividuelle adipöse Organoide in Kombination mit Tumororganoiden aus gleichen Patienten verkürzen das Tumorwachstum signifikant. Dieser Ansatz entfaltet somit eine personalisierte Krebsbehandlung mit autologen Zellen und minimaler Immunreaktion. Zusätzlich zur Konkurrenz um Glukose und Fettsäuren können Adipozyten auch andere für den Tumor wichtige Metabolite konkurrieren. Ein Beispiel liefert die zielgerichtete Überexpression von UPP1, welches die Verwertung von Uridin – einem für Pankreaskrebs wichtigen Stoffwechselsubstrat – in adipösen Organen steigert und so das Tumorwachstum weiter hemmt. AMT wäre dadurch vielseitig anpassbar an verschiedene Tumorstoffwechselprofile und bietet somit eine breite therapeutische Grundlage.
Die Wirkung der modifizierten Adipozyten geht über den bloßen Nährstoffwettstreit hinaus. Implantierte braune bzw. beige Adipozyten verbessern die systemische Glukosehomöostase, steigern die Insulinsensitivität und senken den Insulinspiegel im Blut. Da Insulin ein bekanntes Tumorwachstumsfaktor ist, kann die Senkung des zirkulierenden Insulinspiegels zusätzlich zu einer reduzierten Tumorprogression beitragen. Die Implantation fernab vom eigentlichen Tumor zeigt zudem, dass eine lokale Wirkung nicht zwingend erforderlich ist, da die metabolische Beeinflussung des gesamten Organismus positiv auf die Tumorentwicklung wirkt.
Trotz der ermutigenden Befunde gibt es Herausforderungen und Risiken, die berücksichtigt werden müssen. Die Gefahr der cancer-associated cachexia, also Gewichts- und Muskelverlust bei K rebspatienten, wird durch eine erhöhte Fettmobilisierung und Thermogenese unterstützt und muss durch kontrollierte Implementierung und reversible Systeme gemindert werden. Die darauf aufbauenden Regulationen mittels induzierbarer Systeme oder die Nutzung von entfernbaren Implantaten bieten Lösungen für diese Problematik. Die klinische Umsetzung von AMT ist vielversprechend, da Verfahren wie Liposuktion und Fettgewebetransplantation bereits routinemäßig und sicher in der plastisch-rekonstruktiven Chirurgie angewandt werden. Die Möglichkeit, autologe Fettzellen zu entnehmen, gentechnisch zu modifizieren und innerhalb desselben Patientenkörpers rekonstruktiv einzusetzen, schafft ein einzigartiges, patientenindividuelles Therapiekonzept, vergleichbar mit CAR-T-Zell-Therapien.
Da Adipozyten weniger immunogen sind als T-Zellen, könnten auch „Off-the-shelf“-Lösungen entwickelt werden. Darüber hinaus kann AMT mit anderen Krebstherapien kombiniert werden, um synergistische Effekte zu erzielen. Beispielsweise könnten chemotherapeutische oder immunstimulierende Substanzen über adipöse Zellen verabreicht oder über deren sekretorische Kapazitäten verstärkt werden. Zudem eröffnet die flexible Einsatzfähigkeit von CRISPRa eine breite Palette an genetischen Anpassungen zur Optimierung der metabolischen Konkurrenzfähigkeit. Zusammenfassend markiert die Implantation von gentechnisch modifizierten Adipozyten eine wegweisende Innovation im Bereich der Krebsbehandlung.
Die verstärkte metabolische Nutzung von Nährstoffen durch die modifizierten Fettzellen schwächt effektiv das Tumorwachstum und verbessert zugleich systemische Stoffwechselwerte des Organismus. Die Vielseitigkeit und das Sicherheitspotenzial dieser Strategie machen sie zu einem vielversprechenden Kandidaten für die künftige klinische Krebsbehandlung, mit der Möglichkeit, Therapiepersonalisierten und nebenwirkungsarmen Behandlungsansätzen. Weitere präklinische und klinische Studien werden die Wirksamkeit und Sicherheit bestätigen und dabei helfen, dieses neue Therapiemodell in die Krebsmedizin einzuführen.