Die nichtinvasive Bildgebung des menschlichen Gehirns ist eine der größten Herausforderungen in der modernen Medizin und Neurowissenschaft. Während konventionelle Verfahren wie die funktionelle Magnetresonanztomographie (fMRT) eine hohe räumliche Auflösung bieten, sind sie oft teuer, sperrig und zeitaufwendig. Dagegen zeichnen sich optische Verfahren durch ihre Portabilität, Kosteneffizienz und schnelle Messraten aus, stoßen jedoch aufgrund der hohen Lichtstreuung im Gewebe an ihre Grenzen. Besonders schwierig ist es, Photonen tief in den Kopf hineinzuleiten und auf der gegenüberliegenden Seite wieder zu detektieren – über eine Distanz, die der gesamten Kopfgröße eines Erwachsenen entspricht. Diese Grenze zu durchbrechen bedeutet, das Potenzial der optischen Hirnbildgebung grundlegend zu erweitern.
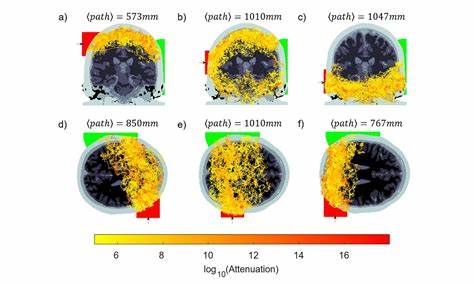
Der Schlüssel zu diesem Fortschritt liegt im Verständnis des Photonentransports durch das komplexe System des menschlichen Kopfes. Anatomisch besteht der Kopf aus mehreren Schichten mit sehr unterschiedlichen optischen Eigenschaften. Haut, Schädelknochen, cerebrospinale Flüssigkeit (CSF), graue und weiße Hirnsubstanz sowie Lufträume interagieren auf komplexe Weise mit Licht im nahinfraroten Spektrum. Während Haut und Knochen stark streuen, bietet die klarere CSF Bereiche mit geringerer Streuung und Absorption, die als "Leitkanäle" für Photonen wirken. Neuere Forschungen zeigen, dass trotz extremer Dämpfung – mit Abschwächungen bis zu einem Faktor von 10^18 – einzelne Photonen auf direktem Weg durch den gesamten Kopf hindurch detektiert werden können.
Dies wurde anhand zeitaufgelöster Photonenmessungen und Monte-Carlo-Simulationen belegt, welche die Ausbreitungswege der Photonen in einem dreidimensional modellierten Kopf nachvollziehen. Die Simulationen berücksichtigen die individuellen optischen Eigenschaften der verschiedenen Gewebeschichten und erlauben so eine detaillierte Kartierung der Photonenmigration. Dabei haben sich sowohl Pfade oberhalb als auch unterhalb der Großhirnrinde als relevant erwiesen, wobei insbesondere die cerebrospinale Flüssigkeit als natürliche, vergleichsweise transparente Brücke dient. Die experimentellen Studien nutzen gepulste Lasersysteme im naheinfraroten Bereich mit hohen Leistungen und großflächiger Beleuchtung, um die Anzahl verfügbarer Photonen zu maximieren. Auf der gegenüberliegenden Seite des Kopfes sammeln speziell designte Photonendetektoren das extrem schwache Signal, und zeitkorrelierte Einzelphotonenzählungsmethoden sorgen für eine hohe Sensitivität und Rauschunterdrückung.
So wird sichergestellt, dass tatsächlich Photonen gemessen werden, die den Kopf vollständig durchquert haben, und nicht versehentliche Streulichtsignale oder Reflexionen. Diese Kombination aus Simulation und Experiment eröffnet neue Wege, um überraschend tiefe Regionen des Gehirns zu erreichen – etwa die Sulci, den Mittelhirn-Bereich und Teile des Kleinhirns, die bisher nicht durch gängige optische Gehirnmessverfahren abgedeckt wurden. Die Implikationen dieser Forschung sind weitreichend. Bisher beschränken sich viele optische Techniken wie die funktionelle Nahinfrarotspektroskopie (fNIRS) vor allem auf die Erfassung oberflächlicher cortexnaher Regionen, da die Lichtintensität mit zunehmender Gewebetiefe exponentiell abnimmt. Die Möglichkeit, Photonen über die gesamte Kopfbreite zu messen, könnte eine neue Generation von optischen Geräten hervorbringen, welche die Tiefenauflösung und Empfindlichkeit deutlich erhöhen.
Insbesondere die Behandlung und Überwachung von tief im Hirn liegenden Pathologien wie Hirnblutungen, Tumoren oder Schlaganfällen könnte davon profitieren. Die Technologie wäre kostengünstiger, mobiler und patientenfreundlicher als bisherige Bildgebungsverfahren. Besonders interessant ist die Erkenntnis, dass durch gezielte Positionierung von Lichtquelle und Detektor unterschiedliche Hirnregionen adressiert werden können. Abweichungen der Quelle um wenige Zentimeter auf der Kopfoberfläche führen zu veränderten Photonenwegen und somit zu unterschiedlichen Tiefenempfindlichkeiten. Dieses Prinzip ermöglichen zukünftige flexible Anordnungen von Sensoren, die eine tomographische Rekonstruktion tief gelegener Absorptionsänderungen im Gehirn erlauben könnten.
Auch wenn die räumliche Auflösung momentan noch nicht an konventionelle Verfahren heranreicht, ist dies ein vielversprechender Ansatz für funktionelle und strukturelle Bildgebung. Die eingesetzten Monte-Carlo-Simulationen bilden hierbei die Grundlage, indem sie die statistischen Wahrscheinlichkeiten von Photonenstreuungen und -absorptionen anhand realistischer Kopfmodelle abbilden. Hochleistungs-Grafikprozessoren erlauben die Durchführung von Billionen von Photonenpfaden, wodurch sehr genaue Wahrscheinlichkeitsverteilungen der Lichtausbreitung entstehen. Diese Simulationen liefern nicht nur eine Erklärung für die experimentellen Ergebnisse, sondern dienen auch dazu, optimale Konfigurationen für zukünftige Messsysteme zu entwickeln. Ein weiterer entscheidender Faktor ist die Wellenlänge des verwendeten Lichts.
Im nahinfraroten Bereich um 800 Nanometer herrscht ein guter Kompromiss zwischen ausreichender Gewebepenetration und empfindlicher Detektion. Die Streuungs- und Absorptionspropertyen von biologischem Gewebe variieren jedoch stark mit der Wellenlänge, so dass Untersuchungen in den sogenannten zweiten und dritten nahinfraroten Fenstern (>1000 Nanometer) vielversprechend sind. Diese Bereiche weisen typischerweise eine geringere Streuung auf und ermöglichen eine noch tiefere Penetration. Die Herausforderung liegt jedoch in der Entwicklung geeigneter hochempfindlicher Detektoren für diese Wellenlängen. Bislang ließen sich solche Messungen nur an Säuglingen oder bei vergleichsweise kleinen und dünnen Köpfen durchführen.
Die in aktuellen Studien dokumentierte Detektion von Photonen über einen 15,5 Zentimeter großen erwachsenen Kopf mit fairer Hautfarbe und ohne Haare stellt daher einen bedeutenden Schritt dar. Allerdings zeigen erste Versuche an weiteren Probanden mit verschiedenem Hauttyp und Haarstruktur, dass nicht bei allen Menschen eine solche Detektion gelingt. Dies unterstreicht die Bedeutung individuell angepasster Systeme und die Notwendigkeit, weitere Parameter wie Hautpigmentierung, Haardichte oder Kopfgröße zu berücksichtigen. Die Messzeiten von bis zu 30 Minuten sind für klinische Anwendungen momentan zwar noch zu lang, doch Verbesserungen in Sensortechnik und Laserleistung könnten die notwendigen Zeiträume deutlich reduzieren. Insbesondere in Anwendungen, bei denen keine Echtzeitdaten erforderlich sind – etwa die Detektion statischer Veränderungen wie Tumore oder chronische Gehirnveränderungen – könnte diese Technik bereits praktikabel sein.
Neben der klinischen Anwendung eröffnet die Erforschung des Photonentransports auch neue wissenschaftliche Möglichkeiten. Ein besseres Verständnis der Lichtausbreitung im Kopf ermöglicht Verbesserungen in der Signalinterpretation bestehender fNIRS- und DOT-Systeme. So könnten Verzerrungen durch Streulicht in der CSF gezielter erkannt und eliminiert werden. Zudem lässt sich durch die Kenntnis der bevorzugten Photonenwege die Bildrekonstruktion verbessern und spezifische Probenahmen auf gewünschte Hirnareale selektieren. Zusammenfassend stellt die Detektion von Photonen, die den gesamten adulten menschlichen Kopf durchqueren, einen Meilenstein in der optischen Hirnbildgebung dar.
Trotz extremer Schwächung des Lichts durch Gewebe und Knochen gelingt es, mithilfe moderner Lasertechnik und hochempfindlicher Detektoren ein quantifizierbares Signal zu erhalten. Die Kombination mit ausgefeilten Simulationsmethoden erlaubt eine präzise Modellierung der Lichtpfade und legt die Basis für die Entwicklung zukünftiger Bildgebungstechnologien, die tiefere und bislang unerreichbare Hirnregionen abbilden können. Die Integration solcher Verfahren in ein klinisches Umfeld verspricht nicht nur tiefere Einblicke in Hirnfunktionen, sondern auch innovative Diagnosemöglichkeiten für neurologische Erkrankungen. Mit weiteren Fortschritten in Technologie und Methodik könnte die optische Durchleuchtung des gesamten Kopfes bald zu einem wichtigen Werkzeug in der Neurologie und Neuroradiologie avancieren – sicher, schnell und nicht invasiv.