Das Altern ist ein natürlicher Prozess, der unseren gesamten Körper betrifft – von der Haut bis hin zu den inneren Organen. Insbesondere das Blut, welches über unser Gefäßsystem jede Körperzelle mit Sauerstoff und Nährstoffen versorgt, unterliegt tiefgreifenden Veränderungen im Laufe der Zeit. Was aber passiert genau auf der Ebene der Blutstammzellen, die kontinuierlich neue Blutzellen produzieren? Forscher am Center for Genomic Regulation in Barcelona haben mithilfe innovativer Technologien ein faszinierendes Detail enthüllt: sogenannte „Barcodes“ in der DNA der Blutstammzellen zeigen auf, wie das Blut altert und warum unser Immunsystem im Alter anfälliger wird. Diese Erkenntnisse stellen einen bedeutenden Durchbruch in der Altersforschung dar und liefern neue Ansatzpunkte für Prävention und Therapie altersbedingter Erkrankungen. Blutstammzellen stehen im Zentrum der Blutbildung – ihre Aufgabe ist es, lebenslang neue Blutzellen zu bilden.
In jungen Jahren ist dieses System durch eine große Vielfalt an aktiven Blutstammzellen gekennzeichnet, die in einem gleichgewichtigen Wettbewerb miteinander stehen. Diese Diversität sorgt dafür, dass das Blut flexibel auf verschiedene Herausforderungen reagieren kann, sei es Infektion, Verletzung oder Stress. Mit zunehmendem Alter schrumpft jedoch die Anzahl aktiver Blutstammzellen spürbar. Studien zeigen, dass bei Menschen ab etwa 50 Jahren und bei Mäusen im vergleichbaren Lebensalter einige wenige Stammzellklone dominant werden, die andere Arten von Stammzellen verdrängen. Diese Veränderungen führen zu einer stark verminderten Vielfalt im Blutstammzellpool – ein Zustand, der die Resilienz des blutbildenden Systems erheblich beeinträchtigt.
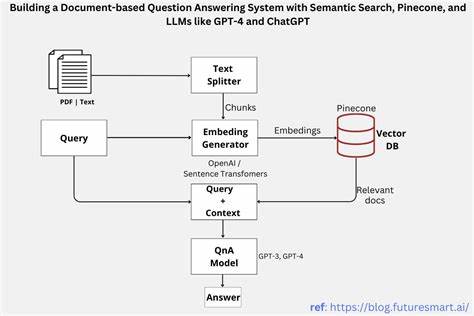
Die Methode, die es ermöglicht, diese Klon-Dynamik zu erkennen, basiert auf epigenetischen Markern, genauer gesagt der DNA-Methylierung. Dabei handelt es sich um chemische Anhängsel an der DNA, die das Aktivitätsmuster der Gene steuern, ohne die genetische Reihenfolge zu verändern. Wenn sich eine Blutstammzelle teilt, werden diese Methylierungsmarken auf die Tochterzellen übertragen und fungieren so als eine Art natürlicher Barcode. Jeder Stammzellklon besitzt ein charakteristisches Muster an Methylierungen, das es erlaubt, die Abstammung und den Einfluss einzelner Klone über die Zeit hinweg zu verfolgen. Dieses nicht-invasive Verfahren wurde von den Forschern unter dem Namen EPI-Clone perfektioniert und basiert auf der Modifikation einer Single-Cell-Sequenzierungstechnologie, mit der zehntausende Einzelzellen auf ihren epigenetischen Status untersucht werden können.
Die mit EPI-Clone gewonnenen Daten enthüllen ein bemerkenswertes Bild: Während junge Blutproben eine vielfältige Mixtur von Hunderten bis Tausenden verschiedener Klone zeigen, dominieren bei älteren Probanden nur noch wenige Dutzend dieser Klone den Großteil der Blutproduktion. Besonders auffällig ist, dass viele dieser dominanten Klone eine Präferenz für die Bildung von myeloiden Zellen zeigen – eine Zelllinie des Immunsystems, die eng mit chronischer Entzündung verbunden ist. Die Wissenschaftler vermuten, dass diese Klonstruktur maßgeblich zur sogenannten „Inflammaging“ beiträgt, einem Zustand dauerhafter, niedriggradiger Entzündung, der viele altersassoziierte Krankheiten wie Herzinfarkt, Schlaganfall oder Krebs begünstigt. Doch nicht nur die Anzahl der aktiven Stammzellklone verändert sich. Das Forschungsprojekt hat ebenfalls gezeigt, dass manche dominante Klone genetische Mutationen tragen, die als klonale Hämatopoese (clonal hematopoiesis, CH) bekannt sind.
Diese Mutationen ermöglichen es den betroffenen Zellen, sich schneller zu vermehren, was mit einem erhöhten Risiko für Bluterkrankungen und kardiovaskuläre Leiden verbunden ist. Interessanterweise verfügen viele der dominanten Klone jedoch über keinerlei bekannte Mutationen, was darauf hinweist, dass die Expansion von klonalen Gruppen ein allgemeines Merkmal des Blutalterns und kein unmittelbarer Hinweis auf Krebsrisiko ist. Für die Medizin eröffnet die Möglichkeit, anhand der DNA-Methylierungsbarcodes das Altern des Blutes präzise zu verfolgen, eine völlig neue Dimension. Künftige klinische Tests könnten so den Zustand des Blutstammzellpools lange vor dem Auftreten äußerer Symptome bewerten. Ein schneller Verlust an Diversity oder das rasche Wachstum potenziell riskanter Klone könnten als Frühwarnzeichen dienen.
Dies würde Ärzten erlauben, präventive Maßnahmen zu ergreifen und altersbedingten Krankheiten gezielter entgegenzuwirken. Darüber hinaus bieten die Erkenntnisse eine Grundlage, um sogenannte Verjüngungstherapien zu entwickeln. Frühere Forschungen an Mäusen haben bereits gezeigt, dass die selektive Entfernung myeloid-biased Stammzellen das Blutbild wieder in Richtung eines jüngeren Zustands verändern und die Bildung von Lymphozyten fördern kann, die wichtig für das Immunsystem sind. Allerdings waren bislang solche Eingriffe beim Menschen kaum umsetzbar, da die Identifizierung der „problematischen“ Klone fehlte. EPI-Clone liefert nun die Werkzeuge, um genau diese Klone zu erkennen, ohne auf eine invasive genetische Manipulation zurückgreifen zu müssen.
Die Entwicklung von EPI-Clone ist ein Innovationserfolg, der sowohl technisches als auch ethisches Neuland betritt. Die Analyse von epigenetischen Mustern statt von Genmutationen macht es möglich, natürliche Veränderungen zu nutzen, die im Laufe eines Lebens auftreten. Dies überschreitet die Grenzen traditioneller genetischer Untersuchungen und vermeidet die ethischen Bedenken, die mit direkter DNA-Manipulation verbunden wären. Die Forscher sind sich einig, dass mit EPI-Clone wichtige Schritte in Richtung personalisierter Medizin im Bereich Altersforschung möglich werden. Die Studie wurde in der renommierten Fachzeitschrift Nature veröffentlicht und beruht auf der engen Zusammenarbeit zwischen dem Center for Genomic Regulation und dem Institute for Research in Biomedicine in Barcelona.
Neben der quantitativen Erfassung bot EPI-Clone auch qualitative Einblicke, die es erlauben, das komplexe Zusammenspiel zwischen den verschiedenen Blutstammzelltypen und ihren epigenetischen Signalen besser zu verstehen. Aus der Sicht der Zukunftsforschung stellt das Verständnis von Blutstammzellalterung eine Schlüsselkomponente dar, um lebensältere Menschen gesünder zu erhalten und die Auswirkungen des demografischen Wandels abzufedern. Denn mit steigender Lebenserwartung wächst die Anzahl an Personen, die unter altersbedingten Erkrankungen leiden. Die durch Forschungsergebnisse wie diese gewonnenen Erkenntnisse helfen, präventive Strategien zu entwickeln, die das Ziel verfolgen, das Immunsystem auch im hohen Alter vital und reaktionsfähig zu halten. Außerdem bieten die gewonnenen Daten Anknüpfungspunkte, um genetische und epigenetische Alterungsmechanismen besser zu kontextualisieren.
Dies trägt zur Entwicklung neuer Biomarker bei, die dazu dienen können, individuelle Alterungsprozesse genauer zu bestimmen und damit personalisierte therapeutische Ansätze zu ermöglichen. In der Zukunft könnten regelmäßige Tests mittels EPI-Clone Teil des medizinischen Routinenchecks werden und dazu beitragen, schädliche Klonexpansionen frühzeitig zu erkennen und gegenzusteuern. Zusammenfassend lässt sich sagen, dass die Entschlüsselung von epigenetischen Barcodes in der DNA als „Blut-Altersuhr“ fungiert und damit das Tor zu einem besseren Verständnis des Alterns, chronischer Entzündungen und altersassoziierter Krankheiten öffnet. Die präzise Nachverfolgung einzelner Blutstammzellklone zeigt einmal mehr, dass Diversität und Flexibilität des blutbildenden Systems für die Gesundheit im Alter entscheidend sind. Neue Technologien wie EPI-Clone bieten vielversprechende Möglichkeiten, um den Alterungsprozess nicht nur zu beobachten, sondern auch aktiv und gezielt zu beeinflussen.
Dies markiert einen wichtigen Schritt auf dem Weg zu einer Altersmedizin, die auf individuellen Daten basiert, Krankheiten frühzeitig erkennt und optimale therapeutische Maßnahmen ermöglicht.