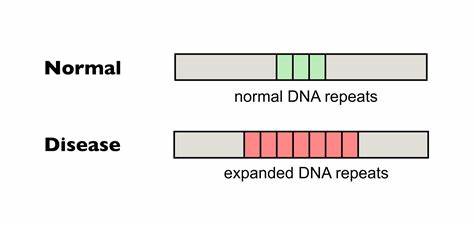
Huntington-Krankheit (HD) gilt als eine der bekanntesten neurodegenerativen Erkrankungen, die durch eine genetisch bedingte Expansion von trinukleotidischen Wiederholungen im Huntingtin-Gen ausgelöst wird. Im Zentrum dieser Pathologie stehen insbesondere expandierte CAG-Repeats, die in längerer Form zu einer dysfunktionalen Form des Huntingtin-Proteins führen und schlussendlich zum Absterben von Nervenzellen, vor allem in den Bereichen des Striatums und des Kortex, führen. Derzeit gibt es zwar zahlreiche Ansätze zur Symptombehandlung, eine effektive Therapie, die die Ursache der Krankheit adressiert und den fortschreitenden Verlust an neuronaler Funktion aufhalten kann, fehlt jedoch noch. Ein entscheidender Faktor bei der Progression der Huntington-Krankheit ist die sogenannte somatische Repeat-Expansion. Dabei verlängern sich die CAG-Wiederholungen nicht nur in den Keimbahnzellen, sondern auch in den somatischen Zellen, vor allem in den betroffenen Hirnregionen, über die Lebenszeit eines Patienten hinweg.
Diese dynamische Instabilität der Repeat-Sequenzen führt zu einer erhöhten Krankheitslast und beschleunigt das Auftreten von Symptomen sowie den Krankheitsverlauf. Viele Forschungsgruppen weltweit beschäftigen sich daher intensiv mit dem Ziel, die somatische Instabilität der CAG-Wiederholungen zu begrenzen oder sogar zu verhindern. Ein vielversprechender Ansatz in diesem Kontext ist die Verwendung von präzisen Genome-Editing-Technologien, insbesondere sogenannter Basen-Editoren. Diese Technologien ermöglichen es, einzelne Nukleotide gezielt und ohne die Einführung von Doppelstrangbrüchen im Genom umzuwandeln. Das bedeutet, dass die perfekte Wiederholung von CAG-Triplets innerhalb der Huntingtin-Gen-Sequenz durch einzelne, gezielt eingesetzte Mutationen unterbrochen werden kann, ohne dass dabei der kodierte Glutamin-Abschnitt des Proteins verändert wird.
Zum Beispiel können CAG-Segmente in CAA umgewandelt werden – beides codiert für Glutamin, jedoch führt die CAA-Interruption zu einer stabileren, weniger expansionsfähigen Sequenz. Aktuelle Studien belegen, dass diese „unterbrochenen“ Repeat-Trakte eine deutlich geringere somatische Expansion zeigen. Untersuchungen an Patienten-Zelllinien zeigten, dass nach Anwendung von Cytosin-Basen-Editoren mit spezifischen Guide-RNAs ein Großteil der zuvor vollkommen homogenen CAG-Repeats durch CAA-Insereengen unterbrochen wurde. Diese Intervention führte zu einer signifikanten Verringerung der somatischen Repeat-Expansionen, was langfristig eine Verlangsamung der Krankheitsprogression erwarten lässt. Die Anwendung von Adenin-Basen-Editoren eröffnet zudem neue Möglichkeiten, da sie bei verwandten trinukleotidischen Repeat-Erkrankungen wie der Friedreich-Ataxie ebenfalls erfolgreich eingesetzt werden können.
Hier zielen Behandlungen darauf ab, GAA-Repeat-Expansionen durch GAG- oder GGA-Interruptionen zu stabilisieren. Die Parallelen zwischen diesen beiden Erkrankungen unterstreichen die Bedeutung der Repeat-Interruption als therapeutische Strategie. Darüber hinaus wurde in Mausmodellen der Huntington-Krankheit mittels AAV-getragener Basen-Editoren eine effektive und langanhaltende Unterbrechung der CAG-Repeats erreicht. Die gezielte Bearbeitung im zentralen Nervensystem führte nicht nur zur Stabilisierung der Repeat-Sequenzen sondern auch zu einer leichten Verkürzung der insgesamt vorhandenen Repeat-Anzahl. Diese „Kontraktion“ der Repeats könnte entscheidend zur Verringerung des toxischen Huntingtin-Effektes beitragen.
Neben den positiven Ergebnissen der Repeat-Interruption zeigen die Untersuchungen auch, dass die Off-Target-Effekte dieser genetischen Eingriffe in kontrollierbaren Grenzen liegen. Zwar sind einzelne Nebenwirkungen auf nicht-zielgenaue Regionen im Genom nicht vollständig ausgeschlossen, doch erhöhen fortschreitende Verbesserungen der Editorenzym-Varianten sowie der Verträglichkeit der verwendeten Vektoren die Sicherheit und das therapeutische Potenzial solcher Methoden. Die somatische Instabilität der CAG-Wiederholungen ist auch eng an das Auftreten von RNA- und DNA-Haarnadelstrukturen gebunden, welche die DNA-Reparaturprozesse stören und zur Expansion beitragen. Jedoch wird durch die gezielte Einführung von Interruptions die Bildung dieser unerwünschten Sekundärstrukturen vermindert, was einen weiteren Schutzmechanismus gegen Expansionen darstellt. Dies unterstreicht die doppelte Wirksamkeit des Editing-Ansatzes.
Neuere Erkenntnisse aus groß angelegten genomweiten Studien zeigen zudem, dass auch geringfügige Variationen in der Zusammensetzung der CAG-Repeats, etwa durch einzelne Interruptions, mit einem signifikanten Rückgang des Erkrankungsrisikos und der Verzögerung des Krankheitsbeginns assoziiert sind. Dieses Phänomen ist insbesondere für Patienten mit CAG-Wiederholungen nahe der pathogenen Schwelle relevant und könnte klinisch von großem Nutzen sein. Ein weiteres wichtiges Entwicklungsthema ist die Verbesserung der Vektor-Technologien, beispielsweise durch Adeno-assoziierte Viren (AAV), zur effizienten und zellspezifischen Auslieferung der Basen-Editoren. AAV9 zeigt hierbei ein hohes Potenzial in der gezielten Besiedelung neuronaler Gewebe, womit das Fortschreiten der Huntington-Krankheit direkt im betroffenen Hirnareal angegangen werden kann. Zugleich wird intensiv an alternativen Vektoren geforscht, um auch andere relevante Gewebe, wie gliale Zellen oder periphere Nervenzellen zu erreichen, die ebenfalls zur Erkrankung beitragen.