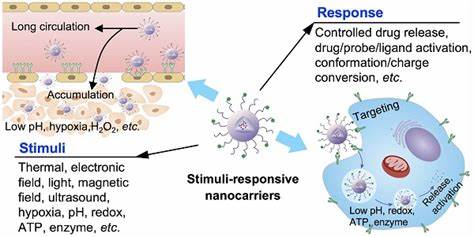
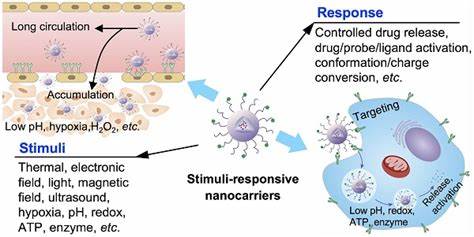
Bakterielle Biofilme stellen in der modernen Medizin eine erhebliche Herausforderung dar. Diese komplexen mikrobiellen Gemeinschaften sind von einer schützenden Matrix umgeben, die aus extrazellulären Polysacchariden und anderen Molekülen besteht und die Bakterien vor antimikrobiellen Substanzen isoliert. Diese Schutzfunktion erschwert die Penetration konventioneller Antibiotika und führt häufig zu therapieresistenten, chronischen Infektionen, die mit herkömmlichen Behandlungsmethoden nur schwer oder gar nicht zu beseitigen sind. Die Entwicklung innovativer Strategien zur gezielten und effektiven Bekämpfung dieser Biofilme ist daher ein zentraler Schwerpunkt aktueller biomedizinischer Forschung. Ein vielversprechender Ansatz, der zunehmend an Bedeutung gewinnt, ist der Einsatz von ultraschallaktivierten nanoskaligen Wirkstoffträgersystemen.
Diese Technologie kombiniert die kontrollierte Freisetzung antimikrobieller Wirkstoffe mit mechanischer Biofilmdisruption durch Ultraschall, was eine gezielte und effiziente Behandlung ermöglicht. Im Kern funktionieren solche Systeme durch die Encapsulation von Arzneistoffen in Nanodroplets – winzige, phospholipidbeschichtete Tröpfchen mit einem flüssigen Perfluorkohlenwasserstoffkern, die unter Ultraschalleinwirkung in Gasblasen transformiert werden. Diese Umwandlung erzeugt akustische Kavitation und mechanische Kräfte, welche das Biofilmgerüst destabilisieren und zugleich die Freisetzung der geladenen Wirkstoffe präzise steuern. Die Vorteile dieser ultraschallgesteuerten Nanodroplets liegen sowohl in der Erhöhung der Lokalisation der Antimikrobiotika als auch in der verbesserten Durchdringung der Biofilmmatrix. Studien zeigen, dass die erforderlichen Antibiotikakonzentrationen für eine effektive bakterielle Eradikation drastisch reduziert werden können, wenn diese Wirkstoffe in Nanodroplets gebunden und durch fokussierten Ultraschall aktiviert werden.
Insbesondere bei problematischen Erregern wie methicillin-resistenten Staphylococcus aureus (MRSA) und Extended-Spectrum-Beta-Lactamase (ESBL) produzierenden gramnegativen Bakterien konnten signifikante Verbesserungen in der antibakteriellen Wirkung beobachtet werden. Ein bemerkenswertes Ergebnis dieser Technologie ist die Fähigkeit der Nanodroplets, die Antibiotikakonzentration im Zellinneren biofilmbewohnender Bakterien signifikant zu erhöhen. Durch Ultraschall-induzierte Blasenbildung entstehen temporäre Poren in der bakteriellen Membran, die das Eindringen von Wirkstoffen in die Zelle erleichtern. Die Konzentration der antimikrobiellen Substanzen im Cytoplasma der Bakterien steigt um das Mehrfache im Vergleich zur Behandlung mit freiem, unverkapseltem Wirkstoff. Dies ist besonders relevant, weil viele Antibiotika nur in ausreichender intrazellulärer Konzentration ihre volle Wirkung entfalten können.
Indem die Nanodroplets als Transportmittel fungieren und die Mehrachsenwirkung mechanischer und pharmakologischer Effekte kombinieren, kann das Biofilm-geschützte Bakterium effektiver bekämpft werden. Die physikalischen Eigenschaften der Nanodroplets sind entscheidend für ihre Wirksamkeit. Die Größe der Tröpfchen bewegt sich meist im Bereich von 125 bis 250 Nanometern, was ihnen eine verbesserte Penetrationsfähigkeit durch die dichte Biofilmmatrix ermöglicht. Zusätzlich gewährleistet die phospholipidbasierte Ummantelung eine hohe Stabilität in biologischen Flüssigkeiten und verlängert die Verweildauer der Wirkstoffe in der Zielstruktur. Die Auswahl der Perfluorkohlenwasserstoffe als flüssiger Kern erlaubt eine kontrollierte Phasenumwandlung bei definierten Ultraschallbedingungen, was die gezielte Freisetzung ohne Nebenwirkungen ermöglicht.
Das im Rahmen aktueller Forschungen eingesetzte Ultraschallsignal ist typischerweise fokussiert und pulsiert mit Frequenzen im Megahertzbereich. Diese Parameter wurden so abgestimmt, dass eine maximale biofilmdisruptive Wirkung erzielt wird, ohne umliegendes Gewebe zu schädigen. Dabei wird die Ultraschallenergie zunächst genutzt, um die Nanodroplets in Mikroblasen zu verwandeln. Die entstehende Kavitation führt zu einem Druckanstieg und starken mechanischen Scherkräften lokal im Biofilm, die das EPS-Gelmatrixnetzwerk aufbrechen oder zumindest durchlässiger machen. In der anschließenden Phase wird die Freisetzung des antimikrobiellen Wirkstoffs angeregt, der nun aufgrund der gelockerten Biofilmstruktur effizienter in die bakterielle Zelle eindringen kann.
Der therapeutische Nutzen dieses Systems wurde sowohl in vitro an klinischen Isolaten von E. coli und S. aureus als auch in simulierten Infektionsumgebungen nachgewiesen. Die antibakterielle Wirksamkeit zeigte sich nicht nur gegen metabolisch aktive planktonische Bakterien, sondern auch gegen sogenannte persister-Zellen – ruhende Zellsubpopulationen, die sich besonders schwer mit herkömmlichen Antibiotika eliminieren lassen. Die Ultraschall-induzierte Resuspension und gleichzeitige mikroskopische Zerstörung der Biofilmarchitektur können Persister reaktivieren, sodass sie durch die freigesetzten Antimikrobiotika abgetötet werden.
Somit kann das Risiko erneuter Infektionsschübe deutlich gesenkt werden. Darüber hinaus erlauben Untersuchungen mit Strömungszellmodellen, die das natürliche Infektionsmilieu simulieren, eine realitätsnahe Beurteilung der Effizienz. Biofilme, die unter Bedingungen gewachsen sind, welche cystische Fibrose-assoziierten Lungeninfektionen, chronischen Wunden oder Gelenkinfektionen entsprechen, zeigten eine signifikante Empfindlichkeit gegenüber Ultraschall-aktivierten Nanodroplet-Behandlungen. Essenziell ist, dass in keinem dieser Fälle lediglich eine passive Biofilmentfernung stattfand. Vielmehr wurde sowohl die Anzahl der lebenden Bakterien reduziert als auch die Matrix selbst effektiv destabilisiert, was die Grundlage für eine nachhaltige Heilung verbessert.
Eine besondere Herausforderung in der Entwicklung antibiofilmärer Therapiemöglichkeiten besteht darin, den Wirkmechanismus auf zellulärer und subzellulärer Ebene besser zu verstehen. Analysen mittels hochsensitiver Massenspektrometrie belegten, dass durch Nanodroplets vermittelte Antimikrobiotika häufiger in den bakteriellen Membranen oder direkt im Zellinneren anzutreffen sind als bei herkömmlichen antibiotischen Formulierungen. Die erhöhte Membranpermeabilität sowie die intrazelluläre Distribution der Wirkstoffe erklären einen Großteil der beobachteten Wirkungssteigerung. Zusätzlich zur Milde gegenüber menschlichen Zellen zeichnen sich diese nanoskaligen Trägersysteme durch ihre Anpassbarkeit aus. Verschiedene Klassen von antimikrobiellen Substanzen, einschließlich makrolide, Fluorchinolone, antimikrobielle Peptide und Metallkomplexe, können in der Nanodroplet-Struktur geladen und individuell freigesetzt werden.
Dies bietet große Flexibilität für die Behandlung verschiedenster Erreger und ermöglicht kombinierte Therapien, die multiple Angriffspunkte adressieren, um Resistenzen zu minimieren. Auch die klinische Übersetzung erscheint vielversprechend. Die verwendeten Nanodroplets basieren auf Modifikationen bereits klinisch zugelassener Ultraschall-Kontrastmittel. Die Ultraschallgeräte selbst sind in vielen Krankenhäusern bereits etabliert und erfüllen regulatorische Standards. Somit kann diese innovative Technologie zügig in die klinische Routine integriert werden, was insbesondere für schwer behandelbare chronische Infektionen von hoher Bedeutung ist.
Fazit ist, dass die Kombination aus nanotechnologisch gestütztem Wirkstofftransport und gezielter Ultraschallaktivierung eine revolutionäre Möglichkeit bietet, bakterielle Biofilme effizient zu bekämpfen. Diese Synergie nutzt mechanische und pharmakologische Prinzipien, um die bisher unüberwindbaren Barrieren von Biofilmen zu durchbrechen und chronische Infektionen wirksam zu behandeln. Mit weiterführender Forschung und klinischen Studien könnte dieses Verfahren zukünftig die Behandlung von Infektionen bei Diabetikern, Patienten mit cystischer Fibrose, Implantat-assoziierten Infektionen und vielen weiteren Krankheitsbildern nachhaltig verbessern und so einen bedeutenden Fortschritt im Kampf gegen antibiotikaresistente Bakterien darstellen.