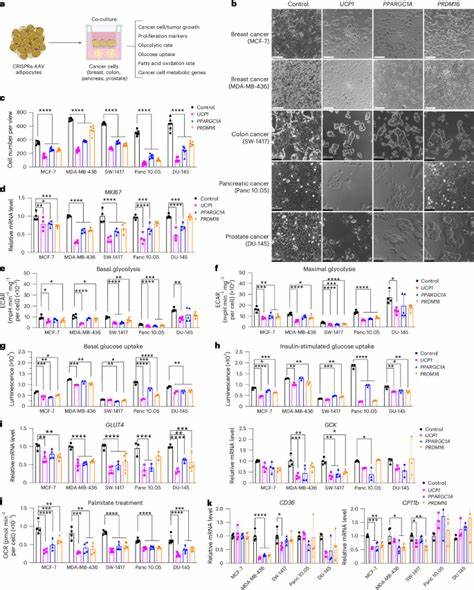
Krebs zählt weltweit zu den schwerwiegendsten Erkrankungen und stellt eine große Herausforderung für die Medizin dar. Tumoren zeichnen sich durch eine starke Zellteilung und einen erhöhten Nährstoffbedarf aus, was dazu führt, dass sie im Gewebe umgebende Ressourcen systematisch „ausrauben“, um ihr unkontrolliertes Wachstum zu unterstützen. Die Fähigkeit von Krebszellen, ihren Stoffwechsel anzupassen und unterschiedliche Energiequellen zu nutzen, macht gezielte Therapien schwierig. Genau hier setzt eine neue, vielversprechende Strategie an: Die Implantation gentechnisch modifizierter Adipozyten – also Fettzellen – die Krebszellen intensiv in Konkurrenz um essenzielle Nährstoffe treten und dadurch deren Wachstum wirksam hemmen. Adipozyten und ihre Rolle im Körper sind vielfältig und reichen weit über die bloße Speicherung von Fett hinaus.
Insbesondere die braunen und beigen Fettzellen, die durch sogenannte „Browning“-Prozesse aktiviert werden können, haben die Fähigkeit, Energie in Form von Wärme zu verbrauchen. Dabei wird vor allem überschüssiger Zucker und Fett abgebaut. Forscher haben nun Methoden entwickelt, weiße Fettzellen so zu modifizieren, dass sie metabolisch aktiver werden und vermehrt Glukose sowie Fettsäuren aufnehmen und verbrauchen. Eine der Schlüsselkomponenten bei dieser Umwandlung ist die gezielte Aktivierung von Genen wie UCP1, welche natürlichen BAT-Zellen (Braunes Fettgewebe) charakteristisch sind und für die Entkopplung der mitochondrialen Atmungskette von der ATP-Synthese zuständig sind. Durch den Einsatz moderner gentechnischer Werkzeuge wie CRISPRa (eine Variante von CRISPR, die die Genexpression gezielt hochreguliert ohne das Genom zu schneiden) gelingt es, diese Gene in Adipozyten gezielt zu verstärken.
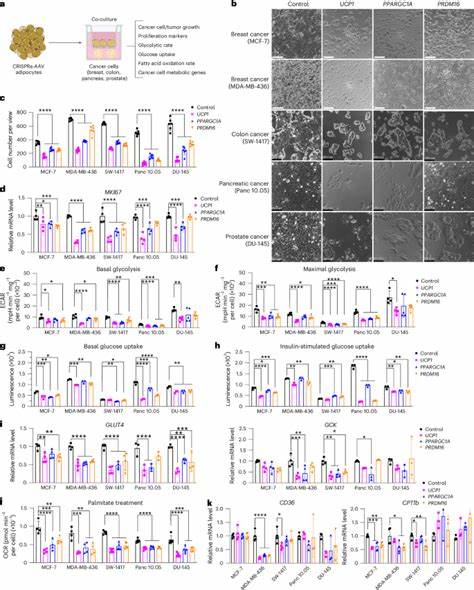
Diese sogenannten „gebräunten“ Adipozyten zeigen eine deutlich gesteigerte Fähigkeit, Nährstoffe aus der Umgebung aufzunehmen und zu verbrauchen. In Krebsmodellen führte die Implantation solcher modifizierten Fettzellorganoide neben Tumoren zu einer signifikanten Verringerung der Tumorgröße und verlangsamter Progression. Dies wurde in verschiedenen Krebsarten wie Brust-, Bauchspeicheldrüsen-, Darm- und Prostatakrebs erfolgreich demonstriert. Die zugrundeliegende Wirkungsweise beruht auf einem direkten Wettbewerb zwischen den adipösen Zellen und den Krebszellen um lebenswichtige Stoffwechselressourcen. Tumorzellen benötigen erheblich viel Glukose und Fettsäuren für ihre Energiegewinnung und Syntheseprozesse.
Werden diese Verbindungen durch die aktiven, transplantierten Adipozyten stark aufgezehrt, steht den Tumorzellen weniger Energiequellen zur Verfügung, was deren Wachstum und Teilung bremst. Interessanterweise spiegelt sich dieser Effekt auch in der Tumormikroumgebung wider. Neben kleineren Tumoren zeigt sich eine verminderte Angiogenese, also die Bildung neuer Blutgefäße, was zusätzlich die Versorgung der Krebszellen verschlechtert. Gleichzeitig reduziert sich die Hypoxie, also Sauerstoffarmut im Tumorgewebe, ein Zustand, der viele Krebszellen aggressiver macht. Darüber hinaus nehmen Marker für Zellproliferation wie Ki67 deutlich ab, während Apoptose-induzierende Faktoren zunehmen.
Das zeigt insgesamt, dass das tumorhemmende Milieu aktiv unterstützt wird. Darüber hinaus wurde dieses Prinzip auch Patientenzellen getestet. Adipozyten, die direkt aus menschlichem Brustgewebe isoliert und im Labor gentechnisch modifiziert wurden, konnten in Ko-Kulturen mit Tumororganoiden aus Brustkrebsproben deren Wachstum verlangsamen und Proliferation unterdrücken. Dies belegt die mögliche Übertragbarkeit und klinische Anwendbarkeit der Methode. Durch die Kombination von gentechnischer Aktivierung mit modernen Zelltherapie-Technologien lassen sich die modifizierten Fettzellorganoide kontrolliert implantieren und sogar regulieren.
So wurde eine induzierbare Steuerung geschaffen, bei der durch Verabreichung von Tetracyclin die Aktivierung der Gene an- oder ausgeschaltet werden kann. Zusätzlich wurde eine innovative Implantationsplattform entwickelt, die aus biologisch abbaubaren Polymer-Mikrowellenscaffolds besteht. Diese bieten einen geschützten und organähnlichen Nährboden für die Adipozyten und erleichtern die Implantation sowie eine spätere Entfernung oder den Austausch der Zelltransplantate. Neben der klassischen Hemmung von Tumorzellen durch gesteigerte Glukose- und Fettstoffwechselkapazität wurde auch ein alternativer Ansatz getestet. So wurde in Adipozyten ein Enzym namens UPP1 hochreguliert, das für die Nutzung von Uridin verantwortlich ist.
Da bestimmte aggressive Bauchspeicheldrüsenkrebsarten auf Uridin angewiesen sind, führt die erhöhte Uridinaufnahme der modifizierten Adipozyten dazu, dass dem Tumor dieses Metabolit entzogen wird und das Wachstum gehemmt wird. Dies zeigt, wie flexibel und anpassbar diese Therapieform auf unterschiedliche Tumorstoffwechselbedürfnisse zugeschnitten werden kann. Ein weiterer positiver Nebeneffekt der Implantation solcher „braunen“ Adipozyten kommt aus den metabolischen Veränderungen des ganzen Körpers. Die behandelten Mäuse zeigten verbesserte Glukosetoleranz und erhöhte Insulinsensitivität. Gleichzeitig sanken die Plasmainsulinwerte.
Das ist ein wichtiger Faktor, da Hyperinsulinämie bekanntlich das Tumorwachstum fördern kann. Durch die Senkung des Insulinspiegels wird also auch indirekt der Tumorwachstum begünstigende Faktor verringert. Aus klinischer Sicht zeichnet sich diese neue Therapieform durch einige entscheidende Vorteile aus. Adipozyten lassen sich relativ einfach durch minimal-invasive Verfahren wie Liposuktion gewinnen und können nach gezielter genetischer Modifikation und Differenzierung als Organoide implantiert werden. Zudem ist ihr Einsatz vergleichsweise wenig immunogen, was potenziell die Notwendigkeit einer intensiven Immunsuppression reduziert.
Das erlaubt sogar die Entwicklung von „off-the-shelf“ Produkten, die für mehrere Patienten geeignet sind. Des Weiteren ist die Technologie reversibel und kontrollierbar. Implantate können entfernt oder durch das Scaffoldsystem ausgetauscht werden, und die genetische Aktivität lässt sich beispielsweise durch medikamentöse Steuerung anpassen. Dies ist besonders relevant, um Nebenwirkungen wie potenziell negative Effekte auf die Körpermasse, wie sie bei längerer brauner Fettgewebeaktivierung gesehen wurden, einzudämmen. Natürlich gibt es noch Herausforderungen, die es zu meistern gilt.
Die langfristigen Auswirkungen einer starken metabolischen Umgestaltung durch implantierte Adipozyten im Menschen müssen sorgfältig untersucht werden. Auch die optimale Anzahl, Verabreichungsorte und Aufbewahrungsbedingungen der transplantierten Zellen gilt es noch zu ermitteln. Dennoch steckt in dieser Zelltherapie-Forschung großes Potenzial, Krebs zukünftig auf eine neue, metabolisch basierte Weise zu bekämpfen. Zusammenfassend eröffnet die verbesserte Implantation und Modifizierung von Adipozyten spannende Möglichkeiten in der Krebstherapie. Indem Fettzellen zu metabolisch aktiven „Ressourcenverbrauchern“ gemacht werden, gelingt es, das Nährstoffangebot für Tumorzellen einzuschränken und diese effektiv zu bekämpfen.
Die flexible, kontrollierbare und patientenfreundliche Natur der Methode macht sie zu einem vielversprechenden Ansatz für die zukünftige Onkologie. Forschungsfortschritte und klinische Studien werden zeigen, wie schnell und effektiv diese innovative Strategie den Weg in die Praxis finden kann.