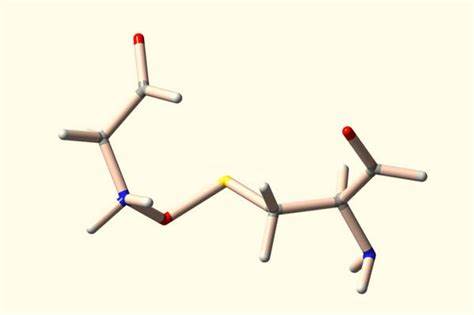
Proteine sind die lebenswichtigen Bausteine aller lebenden Organismen, verantwortlich für zahllose Funktionen wie Strukturgebung, Stoffwechsel und Signalübertragung. Ihre Form und Funktion hängen wesentlich von verschiedenen Arten chemischer Bindungen ab, die ihre dreidimensionale Struktur stabilisieren. Neben den wohlbekannten nicht-kovalenten Kräften und Disulfidbrücken hat eine neue bemerkenswerte Entdeckung gezeigt, dass ein bislang übersehenes Bindungsmotiv in einer Vielzahl von Proteinen existiert und möglicherweise eine bedeutende Rolle in der Biochemie spielt. Diese als NOS-Bindung bezeichnete Struktur verbindet Stickstoff, Sauerstoff und Schwefel in einer kovalenten Wechselwirkung und könnte die Tür zu innovativen Therapieansätzen und verbesserten Protein-Ingenieurtechniken öffnen. Die Entdeckung einer solch weit verbreiteten NOS-Brücke basiert auf einer umfassenden Analyse von über 86.
000 Proteinstrukturen, die im Protein Data Bank (PDB) archiviert sind. Mithilfe modernster maschineller Lernverfahren und quantenmechanischer Berechnungen gelang es Forschern, 69 bisher unbekannte NOS-Bindungen zu identifizieren. Dabei handelt es sich um kovalente Verknüpfungen, die in zahlreichen Proteinfamilien auftreten und bislang häufig als „zu nahe beieinander liegende Atome“ oder als Fehlinterpretationen in Kristallstrukturdaten abgespeichert wurden. Ursprünglich wurde die NOS-Verbindung im Jahr 2021 erstmals zwischen den Aminosäuren Cystein und Lysin beschrieben. Diese Brücke fungierte als eine Art „gespannter Feder“-Mechanismus, bei dem sich die Proteinform je nach Redoxzustand änderte.
Das bedeutete, dass NOS-Bindungen potenziell als biochemische Schalter wirken könnten, die durch reversible Oxidations-Reduktions-Reaktionen die Funktion von Proteinen regulieren. Diese Entdeckung wurde ursprünglich bei einem bakteriellen Protein gefunden, das für die Behandlung von Gonorrhö von Bedeutung war, und warf neue Fragen hinsichtlich der Rolle solcher Bindungen in der Proteinfunktion auf. Im weiteren Verlauf untersuchten Wissenschaftler aus Göttingen mit neu entwickelten Tools gezielt Proteinstrukturdaten nach Hinweisen auf weitere NOS-Bindungen. Insbesondere richteten sie den Fokus auf Paare von Aminosäuren, die Schwefel und Stickstoff aufweisen und in enger räumlicher Nähe zueinander standen. Diese Suchmethode enthüllte, dass NOS-Bindungen nicht nur zwischen Lysin und Cystein existieren, sondern auch Verbindungen zwischen Arginin und Cystein sowie Glycin und Cystein frequent beobachtet werden können.
Bemerkenswert ist, dass diese Bindungen oft fälschlicherweise übersehen oder als Anomalien in Kristallstrukturdaten eingestuft wurden, was eine Neubewertung dieser Daten und möglicherweise vieler Proteinmodelle erfordert. Die Bedeutung dieser NOS-Bindungen liegt in ihrem potenziellen Beitrag zur Stabilität und Regulation von Proteinen. Es ist seit langem bekannt, dass Proteinfaltung und -funktion durch nicht-kovalente Kräfte wie Wasserstoffbrücken, elektrostatische Wechselwirkungen und van-der-Waals-Kräfte bestimmt werden. Jedoch sind kovalente Bindungen wie Disulfidbrücken zwischen Cysteinresten entscheidend für die Stabilität vieler Proteine. Diese Disulfidbrücken sind reversibel und erlauben es Proteinen, ihre Form dynamisch zu verändern, oft als Reaktion auf das zelluläre Redoxmilieu.
Die Entdeckung von NOS-Bindungen bringt einen weiteren Typ von kovalenten Verbindungen ins Spiel, die ähnlich als schaltbare Elemente dienen könnten. Der therapeutische Nutzen solcher redox-sensitiven Bindungen wird bereits erforscht. So wurde 2024 in einer Zusammenarbeit unter Beteiligung des Teams aus Göttingen gezeigt, dass ein Cystein-Protease-Enzym von SARS-CoV-2 über solche Redoxschalter verfügt. Diese Mechanismen ermöglichen es dem Virus, seine Enzymstruktur unter oxidativen Bedingungen stabil zu halten und gegenüber der Immunabwehr resistent zu sein. Das gezielte Stören dieser NOS-Bindungen könnte somit eine innovative Therapie gegen COVID-19 darstellen, indem die virale Proteinfunktion gezielt beeinträchtigt wird.
Allerdings ist die wissenschaftliche Gemeinschaft in Bezug auf die Dynamik dieser NOS-Bindungen noch gespalten. Einige Experten bezweifeln, ob diese Verbindungen tatsächlich reversibel sind und mechanistisch als funktionelle Schalter agieren können. Bislang liegt der klare Nachweis dafür aus, dass NOS-Bindungen brechen und sich wieder bilden können, noch nicht vor. Dennoch ist das Potenzial für solche Bindungen, als strukturgebende oder regulatorische Elemente zu fungieren, unbestritten und motiviert weitere Forschungen. Ein wesentlicher Aspekt, der zu der anfänglichen Vernachlässigung dieser Bindungen beitrug, liegt in der Art und Weise, wie Proteinstrukturen traditionell interpretiert werden.
Bei der Modellierung von Proteinen anhand von Röntgenbeugungsdaten werden Elektronendichtekarten genutzt, um atomare Positionen zu bestimmen. Doch dabei verlassen sich Strukturbiologen häufig auf chemische Bibliotheken und vordefinierte Regeln über bekannte Bindungstypen. Stehen diese Regeln nur begrenzt zur Verfügung oder fehlen Bindungstypen in den Datenbanken, werden anomale Bindungen, wie NOS-Strukturen, schnell übersehen oder als Artefakte eingestuft. Zudem werden diese Proteinmodelle oft als Trainingsdaten für Künstliche Intelligenz (KI) verwendet, wodurch eine „Fehlinformation“ systematisch weitergegeben werden kann, solange die ursprünglichen Daten unvollständig bleiben. Der Fortschritt in der Erkennung neuer Bindungen und chemischer Modifikationen in Proteinen ist daher auch ein Weg, die korrekte Datenqualität in öffentlichen Datenbanken zu verbessern.
Dies ist für die gesamte biochemische und medizinische Forschung von großer Bedeutung, da missinterpretierte oder fehlende Bindungen die Entwicklung von Medikamenten und biomolekularen Technologien beeinträchtigen können. Sophia Bazzi und ihr Team treiben die Suche nach weniger bekannten chemischen Interaktionen in Proteinen weiter voran. Über NOS-Bindungen hinaus wollen sie weitere unterschätzte oder unbekannte kovalente Modifikationen aufdecken, die funktionale und strukturelle Relevanz besitzen könnten. Ihre Arbeit ist ein bedeutender Beitrag zur Proteomik und zur Strukturbiologie im Zeitalter von Big Data und künstlicher Intelligenz. Die Erkennung und korrekte Einordnung neuer Bindungsmotive wie der NOS-Brücken kann das Verständnis von Proteinmechanismen deutlich erweitern.
Sie zeigt, wie dynamisch und komplex die Chemie des Lebens tatsächlich ist und wie viel Potenzial noch in der Erforschung der molekularen Basis von biologischen Funktionen steckt. Das Potenzial, diese molekularen Mechanismen für medizinische Innovationen und die Verbesserung von Biotechnologie zu nutzen, lädt zur intensiven interdisziplinären Zusammenarbeit ein – von Biochemikern über Strukturbiologen bis hin zu KI-Experten. Die Entdeckung dieses bisher vernachlässigten Bindungsmotivs ist ein Weckruf für die wissenschaftliche Gemeinschaft, genauer hinzuschauen und die Grenzen der etablierten Dateninterpretation zu hinterfragen. Sie unterstreicht die Wichtigkeit einer offenen und neugierigen Forschungsperspektive, um die Komplexität des Lebens auf molekularer Ebene besser zu erfassen und für die Gesellschaft nutzbar zu machen.