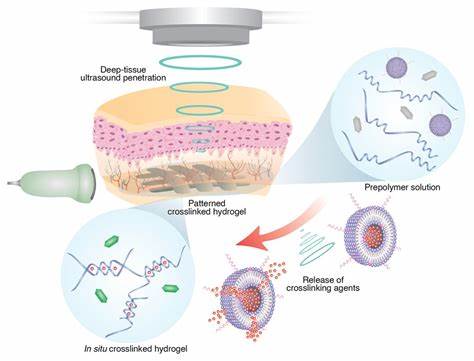
Die moderne Medizin steht vor ständigen Herausforderungen, wenn es darum geht, Behandlungen gezielt und schonend tief im Körperinneren durchzuführen. Eine bahnbrechende Lösung bietet die kürzlich von Wissenschaftlern des California Institute of Technology (Caltech) entwickelte Methode des tiefliegenden, in vivo Ultraschall-3D-Drucks, auch bekannt als Deep Tissue In Vivo Sound Printing (DISP). Diese Technologie verspricht, die Art und Weise, wie Ärzte tief in inneren Organen therapieren und Gewebe reparieren, grundlegend zu verändern. DISP nutzt die einzigartige Fähigkeit von fokussiertem Ultraschall, tief in lebendes Gewebe einzudringen und gleichzeitig präzise auf mikroskopischer Ebene zu wirken, ohne invasive Eingriffe zu erfordern. Dabei wird ein injizierbarer flüssiger Bioink aus polymerisierbaren Monomeren in den Körper eingebracht, der speziell mit temperaturempfindlichen Liposomen versetzt ist.
Diese Liposomen enthalten Wirkstoffe, die bei einer minimalen Temperaturerhöhung – erzeugt durch den Ultraschallpunkt – freigesetzt werden und dort die Polymerisation auslösen. Die Folge ist die gezielte Verfestigung und das lokale 3D-Drucken polymerer Strukturen direkt im Gewebe. Diese innovative Methode hebt sich von bisherigen 3D-Druckansätzen dadurch ab, dass das Drucken nicht außerhalb des Körpers erfolgt, sondern direkt im Zielgewebe. Dadurch können beispielsweise Wunden versiegelt, Gewebe stabilisiert oder therapeutische Wirkstoffe in maßgeschneiderter Form appliziert werden – ohne dass größere chirurgische Eingriffe nötig sind. Zudem ermöglicht die Verwendung von Gasvesikeln als Kontrastmittel bei der Ultraschallbildgebung, den Prozess in Echtzeit zu beobachten.
Diese winzigen, luftgefüllten Proteinblasen stammen aus Bakterien und verändern ihr Ultraschallsignal beim Aushärten des Druckmaterials, wodurch Ärzte präzise verfolgen können, wie und wo die Struktur im Inneren des Körpers entsteht. Ein besonders vielversprechendes Anwendungsgebiet für DISP ist die zielgerichtete Behandlung von Tumoren. Forschungsteams haben bereits erfolgreich belastete Hydrogele mit Chemotherapeutika wie Doxorubicin in Mäusen direkt an der Tumorstelle gedruckt. Die Ergebnisse zeigten eine deutlich höhere Wirksamkeit gegenüber konventionellen Injektionen, da der Wirkstoff genau dort freigesetzt wird, wo er benötigt wird. Neben der Steigerung der Effektivität wurde auch die Schädigung des umliegenden gesunden Gewebes reduziert, was die Nebenwirkungen potenzieller Therapien minimiert.
Die Entwicklung dieses Verfahrens ist ein Beispiel für multidisziplinäre Zusammenarbeit, an der Universitätsexperten aus den Bereichen Medizintechnik, Mechanik und Biomedizin aus mehreren renommierten Instituten beteiligt waren. Neben Caltech trugen auch das Heritage Medical Research Institute, die University of Utah, die University of Southern California, UCLA und Rice University zu den Fortschritten bei. Unterstützt wird das Projekt durch Fördermittel von Organisationen wie den National Institutes of Health und der American Cancer Society. Die Zukunft von DISP ist vielversprechend, vor allem mit Blick auf den Einsatz von Künstlicher Intelligenz (KI) und maschinellem Lernen, die ein autonomes und hochpräzises Drucken in beweglichen Organen ermöglichen sollen – etwa in einem schlagenden Herzen. Die Herausforderung liegt darin, die Drucktechnik an dynamische biologische Umgebungen anzupassen, um selbst kleinste Bewegungen und Veränderungen zu kompensieren und eine stets optimale Applikation sicherzustellen.
Diese neuartige Verbindung von Ultraschalltechnologie und 3D-Druck eröffnet zudem spannende Perspektiven in anderen medizinischen Bereichen wie der regenerativen Medizin, bei der das Drucken von Stützstrukturen für Gewebeerneuerung oder die zielgerichtete Freisetzung von Wirkstoffen an sonst schwer zugänglichen Stellen großes Potenzial birgt. Kombiniert mit fortschrittlichen Bildgebungstechniken lassen sich präzise und minimalinvasive Therapiekonzepte realisieren, die den Heilungsprozess beschleunigen und den Patientenkomfort erhöhen. Auch in der Grundlagenforschung dürfte DISP eine Rolle spielen, indem Wissenschaftler nun erstmals live im Organismus komplexe biochemische Prozesse beeinflussbare Strukturen erzeugen können. So könnten Krankheiten besser modelliert und Therapien maßgeschneidert entwickelt werden. Die Entwicklung von Ultraschall-basierten 3D-Druckverfahren ist jedoch keine Neuerfindung an sich.
Bereits in den vergangenen Jahren wurden verschiedene Ansätze vorgestellt, die akustische Energienutzung zum Formen von Materialien erforschten. Die direkte Schallimplantation (Direct Sound Printing) der Concordia University etwa erzeugt durch sonochemische Effekte hochpräzise Strukturen. Ebenso wurde an Universitäten wie Bath und Bristol die Sonolithografie entwickelt, ein Verfahren, bei dem Ultraschall Teilchen und Flüssigkeitspartikel zielgenau zu vorgegebenen Mustern anordnet. Diese technologischen Fortschritte festigen den Trend, dass Ultraschall künftig nicht nur diagnostisch, sondern auch therapeutisch und als Baustein in der Bioproduktion eine Schlüsselrolle spielen wird. DISP stellt dabei einen Meilenstein dar, der zeigt, wie eng medizinische Nanotechnologie, Materialwissenschaft und bioingenieurtechnische Verfahren ineinandergreifen können.