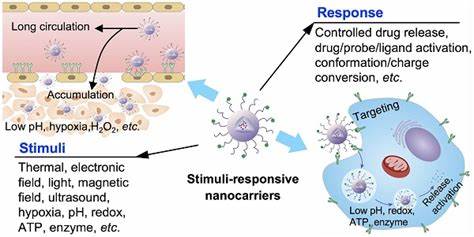
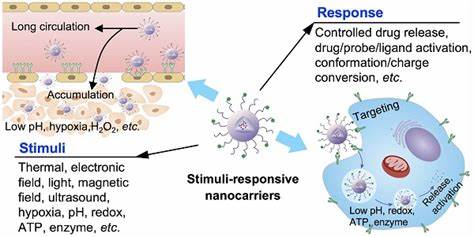
Chronische bakterielle Infektionen gehören zu den gravierendsten Problemen in der modernen Medizin. Insbesondere Biofilme spielen eine zentrale Rolle bei der Persistenz von Infektionen und der Resistenzentwicklung gegen Antibiotika. Biofilme sind komplexe, mikrobiologische Gemeinschaften, die von einer schützenden extrazellulären Polymermatrix (EPS) umgeben sind. Diese Matrix erschwert das Eindringen von antimikrobiellen Substanzen und bietet einen sicheren Rückzugsort für Bakterien, in dem sie sich vor dem Immunsystem und der Wirkung von Medikamenten schützen können. Das Ergebnis ist eine erhebliche Resistenz gegenüber herkömmlichen Therapieansätzen und das Risiko für wiederkehrende und schwer heilbare Infektionen, wie sie beispielsweise bei diabetischen Fußulzera, chronischen Wunden, Protheseninfektionen oder in der Lunge von Mukoviszidose-Patienten auftreten.
Die Grenzen klassischer Antibiotikabehandlungen liegen vor allem in der unzureichenden Penetration in die dichte Biofilmmatrix sowie der eingeschränkten Wirksamkeit gegen persistente und metabolisch inaktive Bakterienzellen, sogenannte Persister. Um diesem Problem zu begegnen, gewinnt die Forschung an intelligenten, stimuli-responsiven Wirkstoffträgersystemen zunehmend an Bedeutung. Dabei rücken ultraschallaktivierte nanoskalige Trägersysteme in den Fokus, welche die gezielte Freisetzung und gleichzeitig die Disruption der Biofilme ermöglichen. Ultraschall bietet eine einzigartige Methode, um Biofilme lokal und kontrolliert zu beeinflussen. Die Einwirkung von fokussiertem Ultraschall kann physikalische Effekte wie Kavitation hervorrufen, bei denen Gasblasen in Flüssigkeiten schwingen, wachsen und kollabieren.
Dies führt zu mechanischen Kräften, die die Biofilmstruktur aufbrechen, die Matrix öffnen und so das Eindringen von antimikrobiellen Wirkstoffen ermöglichen. Besonders innovativ sind hier sogenannte Nanodroplets, kleine, phospholipidbeschichtete Tröpfchen mit einem flüssigen Perfluorcarbonkern, die bei Ultraschalleinwirkung vaporisieren und in Mikroblasen umgewandelt werden. Diese Mikroblasen schaffen eine mechanische Kraft zur Biofilmzerstörung und setzen gleichzeitig den in den Nanodroplets eingebetteten Wirkstoff frei. Die Kombination aus Nanodroplet-basiertem Wirkstofftransport und Ultraschallaktivierung zeigt herausragendes Potenzial im Kampf gegen Biofilme. So konnten Studien nachweisen, dass durch diesen Ansatz die wirksame Konzentration der eingesetzten Antibiotika gegenüber frei verabreichten Wirkstoffen um das Vielfache reduziert wird.
Die Lokalisierung und Akkumulation von Medikamenten in biofilmbewohnenden Bakterien erhöht sich signifikant, was eine effektivere Eliminierung auch hartnäckiger Bakterienzellen ermöglicht. Im Bereich der Wirkstoffe wurden unterschiedliche antimikrobielle Substanzen erfolgreich in Nanodroplets eingebracht, darunter klassische Antibiotika wie Azithromycin und Fluorchinolone sowie polymyxinhaltige Peptide und neuartige metallbasierte Komplexe. Diese Vielfalt ermöglicht die Anpassung der Therapie an verschiedene bakterielle Spezies und Resistenzmechanismen. Insbesondere die Einbindung eines rutheniumbasierten Komplexes stellt einen vielversprechenden Ansatz dar, da dieser eine andere Wirkungsweise mitbringt und so zur Überwindung bestehender Resistenz beitragen kann. Die Synthese der Nanodroplets basiert meist auf zugelassenen Kontrastagenten für die Ultraschalldiagnostik, was die klinische Translation erleichtert.
Die Nanopartikel weisen eine Größe von etwa 125 bis 250 Nanometern auf, damit sie tief in Biofilme eindringen und über die Mikrozirkulation gut verteilt werden können. Dabei ist die Stabilität dieser Systeme essenziell für ihre Wirksamkeit. Untersuchungen belegen, dass diese Trägersysteme bei physiologischen Bedingungen über längere Zeiträume stabil bleiben und ihre Funktionalität behalten. Experimentelle Ergebnisse zeigen, dass die ultraschallaktivierten Nanodroplets sowohl das Biofilm-EPS mechanisch aufbrechen als auch die intrazelluläre Aufnahme der Medikamente steigern. Dies führt zu einer signifikanten Reduktion der notwendigen Medikamentendosis bei gleichzeitig höherer Wirksamkeit gegen planktonische, biofilmbewohnende und sogar persisterzellenartige bakterielle Populationen.
Gleichzeitig wird die Gefahr einer systemischen Toxizität minimiert, da der Wirkstoff gezielt lokal freigesetzt wird. Ultraschall allein hat zwar einen gewissen Effekt auf die Biofilmstruktur, er ist aber nicht ausreichend zur kompletten Bakterienelimination. Die synergistische Kombination mit nanodroplet-gebundenen Antimikrobiotika hebt diese Effektivität jedoch deutlich an. Zudem fördern Ultraschallwellen die Wiederbelebung metabolisch inaktiver Persisterzellen aus ihrem Ruhezustand, was diese für Antibiotika angreifbar macht. Die gezielte Freisetzung zum optimalen Zeitpunkt erhöht somit die Erfolgschancen einer vollständigen Infektionsbehandlung.
Die Anwendungsmöglichkeiten solcher ultraschallgesteuerten Systeme erstrecken sich über diverse klinische Indikationen. Ob chronische Wunden, Implantat-assoziierte Infektionen oder Probleme bei Harnwegs- und Atemwegsinfektionen einschließlich cystischer Fibrose, die Möglichkeit, Biolayer in situ zu zerstören und gleichzeitig antimikrobielle Wirkstoffe tief in die Infektionsstelle zu bringen, bietet großes therapeutisches Potenzial. Technisch kann die Nanodropletvaporisation präzise mit klinisch etablierten Ultraschallgeräten ausgelöst werden. Dies eröffnet Chancen für minimal-invasive, gezielte Therapien, die mit einer routinemäßigen Ultraschalldiagnostik kombinierbar sind und somit Effizienz und Patientenkomfort steigern. Zukunftsorientiert lassen sich solche Plattformen auch für die Abgabe neuartiger antibiofilmischer Substanzen erweitern, etwa von Enzymen, die die Biofilmmatrix abbauen, oder bioaktiven Gasen, die bakterielle Kommunikation stören.
Damit könnten Resistenzen weiter reduziert und eine nachhaltige Antibiotikaverwendung gefördert werden. Abschließend zeigt der innovative Einsatz von Ultraschall in Kombination mit antimikrobiell beladenen Nanodroplets eine vielversprechende Möglichkeit auf, biologische Barrieren wie Biofilme effektiv zu überwinden und lange bestehende therapeutische Herausforderungen zu adressieren. Die Balance zwischen mechanischer Biofilmdisruption und kontrollierter, zielgerichteter Freisetzung antibakterieller Wirkstoffe setzt neue Maßstäbe in der Infektionsbehandlung. Weiterführende klinische Studien und technologische Optimierung könnten diesen Ansatz bald zum Bestandteil moderner Infektionsmedizin machen und somit die steigende Bedrohung durch multiresistente bakterielle Infektionen wirkungsvoll einhegen.