Krebs gilt weltweit als eine der größten gesundheitlichen Herausforderungen, und die Suche nach innovativen Therapien nimmt stetig zu. Ein neuer vielversprechender Ansatz beschäftigt sich mit der Nutzung modifizierter Fettzellen, sogenannter Adipozyten, um das Tumorwachstum effektiv zu unterbinden. Die Implantation dieser genetisch optimierten Adipozyten hat in verschiedenen Krebsmodellen bereits beeindruckende Ergebnisse erzielt und könnte zukünftig eine wichtige Rolle in der personalisierten Krebsbehandlung spielen. Tumoren zeichnen sich durch ein gesteigertes Verlangen nach Nährstoffen aus, die für ihr rasches Wachstum und ihre Vermehrung notwendig sind. Besonders Glukose und Fettsäuren dienen als Energielieferanten, die sie durch eine metabolische Umprogrammierung effizient aufnehmen und verwerten.
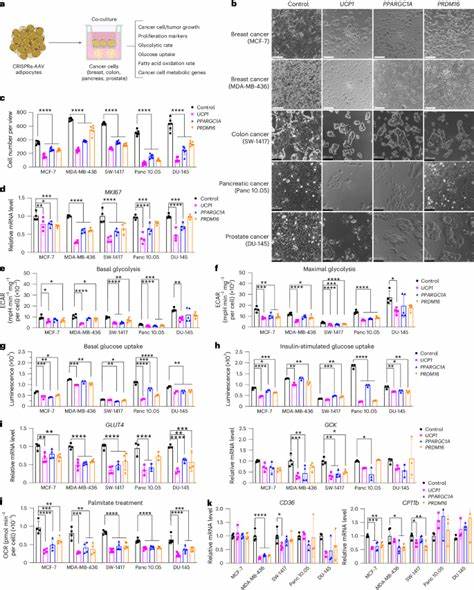
Herkömmliche Therapiestrategien versuchen häufig, die Stoffwechselwege der Krebszellen direkt zu hemmen. Doch dieser Ansatz ist oft mit Nebenwirkungen verbunden und trifft nicht immer zielgerichtet das Tumorgewebe. Die neue Therapieform nutzt hingegen einen indirekten, jedoch wirkungsvollen Mechanismus. Dabei werden Adipozyten so verändert, dass sie eine erhöhte Aufnahme und Verwertung von Glukose und Fettsäuren vornehmen. Dies geschieht durch eine gezielte Aktivierung von Genen, die an der sogenannten Braunen-Fett-Zell-Biogenese beteiligt sind, allen voran das Gen für das Entkopplungsprotein 1 (UCP1).
Dieses Protein steigert die Energieumsatzrate der Fettzellen und verwandelt sie in sogenannte beige oder braune Adipozyten, welche einen hohen Kalorienverbrauch besitzen und durch die Wärmeproduktion einen erhöhten Stoffwechsel aktivieren. Die so modifizierten Adipozyten sind in der Lage, im Umfeld von Tumoren effektiv konkurrierend die verfügbaren Nährstoffe aufzunehmen und dadurch die Versorgung der Krebszellen zu reduzieren. Dies führt zu einer Hemmung des Tumorwachstums und verändert wesentlich die Tumormikroumgebung. Studien in präklinischen Modellen wie Maus-Maßstabsversuchen mit Brust-, Pankreas- und Prostatakrebs haben gezeigt, dass durch die Implantation solcher Adipozyten substanzielle Tumorminderungen erreicht werden konnten. Die Tumoren wiesen neben einem verkürzten Wachstum auch verringerte Marker für Proliferation sowie reduzierte Angiogenese und Hypoxie auf – Faktoren, die typischerweise das Fortschreiten und die Metastasierung von Krebs begünstigen.
Darüber hinaus konnten mit diesen Methoden auch Patientengewebe anhand von Brustkrebsorganoiden behandelt werden, welche aus menschlichen Tumorgeweben gewonnen wurden. Hier zeigte sich ebenfalls eine signifikante Reduktion von Tumorproliferation und eine Hemmung der Stoffwechselwege, die Krebszellen zum Energiestoffwechsel verwenden. Besonders bemerkenswert ist, dass diese Therapieform auch bei Patienten mit genetischem Risiko für Brustkrebs, etwa mit BRCA1- oder BRCA2-Mutationen, das Wachstum vor-maligner Organstrukturen reduzieren konnte. Dies weist auf ein großes Potenzial der Anwendung in der Krebsprävention beziehungsweise Frühtherapie hin. Die zugrunde liegende Methode zur genetischen Modifikation beruht auf der Verwendung von CRISPRa (CRISPR Activation), einer Technologie, die gezielt bestimmte Genabschnitte aktivieren kann, ohne das Erbgut dauerhaft zu verändern.
So werden Adipozyten ex vivo, also außerhalb des Körpers, mit Hilfe von viralen Vektoren mit CRISPRa ausgestattet, um die Expression für wichtige braune Fett-assoziierte Gene wie UCP1, PPARGC1A und PRDM16 zu steigern. Anschließend werden diese veränderten Fettzellen als Organoide implantiert und können durch ihre gesteigerte Nährstoffaufnahme den Tumor quasi „aushungern“. Eine Besonderheit dieser Therapieform ist die Möglichkeit, die Aktivität der implantierten Adipozyten gezielt regulieren zu können. So wurden Systeme entwickelt, die mittels eines Tetracyclin-induzierbaren Schaltermechanismus die Genaktivierung an- und ausschalten lassen. Das ermöglicht eine reversible und kontrollierbare Therapeutik, die bei Bedarf angepasst oder deaktiviert werden kann, um Nebenwirkungen oder andere Komplikationen zu minimieren.
Zudem ermöglichen moderne Implantationsverfahren, die modifizierten Adipozyten in einem biokompatiblen dreidimensionalen Gerüst zu präsentieren, eine verbesserte Stabilität und Integration im Körper. Solche Mikrowellengerüste aus biolöslichem Material unterstützen nicht nur das Überleben und die Funktion der Fettzellen, sondern erleichtern auch deren Positionierung und mögliche Entfernung, falls dies gewünscht ist. Neben der Glukose- und Fettsäureverwertung kann die AMT (Adipose Manipulation Transplantation) Methode auch auf andere stoffwechselbasierte Schwachstellen von Tumoren angepasst werden. So wurden zum Beispiel Adipozyten mit erhöhter Expression von Uridinphosphorylase 1 (UPP1) erzeugt, die in der Lage sind, Pancreas-Duktal-Adenokarzinome gezielt an eigenem Uridin zu hindern. Dadurch wird ein weiterer, tumorabhängiger metabolischer Stoffwechselweg blockiert und das Tumorwachstum gehemmt.
Die Kombination solcher maßgeschneiderten Strategien innerhalb der AMT bietet die Chance auf eine hochoptimierte und tumorangepasste Behandlung. Interessanterweise zeigt sich, dass die Wirkung der implantierten modifizierten Adipozyten nicht nur lokal beschränkt ist. Auch bei einer Implantation distal vom Tumor können sie das Wachstum hemmen, was auf systemische Veränderungen der Stoffwechsellage des Körpers hindeutet. Zum Beispiel wurden bei den behandelten Mäusen reduzierte Insulinspiegel und verbesserte Glukosetoleranz gemessen, die ebenfalls zur Hemmung des Tumorwachstums beitragen können, da Insulin als Wachstumsfaktor Krebszellen stimulieren kann. Die Einbettung der AMT in bestehende klinische Verfahren erscheint vielversprechend.
Adipozyten können mittels Liposuktion beim Patienten gewonnen und nach Modifikation wieder transplantiert werden. Gerade bei Brustkrebspatientinnen, die oft mit rekonstruktiven Operationen behandelt werden, könnte diese Methode unkompliziert integriert werden. Da gesucht wird, Risiken von Immunreaktionen durch Transplantate gering sind, sind auch „off-the-shelf“-Lösungen möglich, bei denen modifizierte Adipozyten von Spendern verwendet werden. Herausforderungen bleiben jedoch bestehen. Dazu zählt unter anderem die mögliche Auslösung einer Krebskachexie, einer bei Krebserkrankungen häufig auftretenden Gewebe- und Muskelerschlaffung durch Stoffwechselveränderungen.