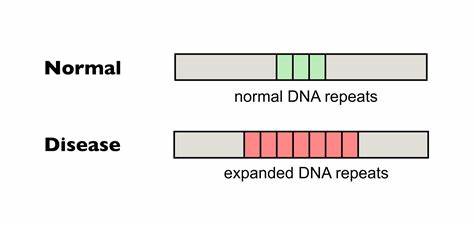
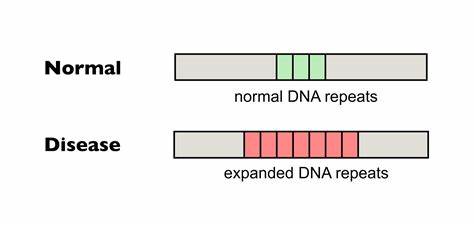
Huntington ist eine erblich bedingte neurodegenerative Erkrankung, die durch die Expansion einer trinukleotidischen CAG-Repeat-Sequenz im HTT-Gen verursacht wird. Die Anzahl der CAG-Wiederholungen bestimmt maßgeblich den Ausbruch und die Schwere der Krankheit. Insbesondere längere, ununterbrochene Repeat-Trakte erhöhen die Instabilität der DNA und fördern somit die somatische Expansion, was mit einer schnelleren Verschlechterung neurologischer Funktionen einhergeht. Die somatische Repeat-Expansion tritt in verschiedensten Geweben auf, besonders ausgeprägt im zentralen Nervensystem, und spielt eine grundlegende Rolle in der Pathogenese von Huntington sowie anderen trinukleotidrepeatspezifischen Erkrankungen. Die Forschung zum gezielten Editieren dieser Wiederholungen gewinnt aktuell zunehmend an Bedeutung.
Traditionelle Therapien fokussieren sich hauptsächlich auf symptomatische Behandlung, wodurch eine kausale Therapie bisher noch nicht realisiert wurde. Moderne präzise Gen-Editierungsmethoden, insbesondere das sogenannte Base Editing, ermöglichen es nun jedoch, einzelne Nukleotide innerhalb der CAG-Trakte zu verändern, ohne dabei die DNA doppelt zu schneiden. Durch gezielte Umwandlung von Cytosin zu Thymin oder Adenin zu Guanin lassen sich CAG-Repeat-Strecken durch stille Mutationen in CAA-Trips unterbrechen. Diese natürlichen Unterbrechungen, die bei manchen Menschen vorteilhafterweise vorkommen, sind für eine deutlich verminderte somatische Instabilität bekannt. Die Einführung von CAA-Unterbrechungen in das HTT-Gen mittels Cytosin-Basen-Editoren wurde erfolgreich in patientenabgeleiteten Fibroblasten sowie in humanisierten Mausmodellen demonstriert.
Die Ergebnisse zeigen eine deutliche Reduktion somatischer Expansionen der CAG-Wiederholungen, was auf eine Stabilisierung des pathologischen Lokus hindeutet. Besonders bemerkenswert ist, dass diese Basen-Editing-Strategien nicht nur die Expansion hemmen, sondern sogar zur Kontraktion der Repeat-Länge beitragen können. Die Verabreichung mithilfe serotropspezifischer Adeno-assoziierter Viren (AAV9) ermöglicht eine effiziente Editierung direkt in neuronalen Zielzellen, die von Huntington besonders betroffen sind. Wichtig für die Sicherheit dieser Strategien ist die Evaluierung eventueller Off-Target-Effekte. Umfangreiche Analysen mittels CIRCLE-seq und Hochdurchsatzsequenzierung der gesamten Genome von behandelten Zellen haben ergeben, dass die meisten Nebenwirkungen entweder in nicht-kodierenden Bereichen oder als harmonische, nicht schädliche stille Mutationen auftreten.
Lediglich ein kleiner Prozentsatz an potenziell kodierenden Off-Target-Stellen weist benigne Charakteristiken auf, die das Risiko von Funktionsstörungen verringern. Dennoch ist eine sorgfältige, langfristige Überwachung in weiteren Studien ratsam, um etwaige kumulative Effekte auszuschließen. Das Konzept des somatischen Gen-Editings könnte einen Paradigmenwechsel in der Behandlung von Huntington und verwandten trinukleotidbasierenden Erkrankungen markieren. Die Minimierung oder Verhinderung somatischer Repeat-Expansionen würde den Krankheitsverlauf verlangsamen und könnte lebensverbessernde Effekte bringen. Tierstudien mit Langzeitbeobachtungen und größeren Patientenzellpopulationen liefern zunehmend überzeugende Evidenz für die Wirksamkeit und Sicherheit der Basen-Editing-Technologie.
Ein weiteres interessanten Forschungsgebiet ist die klinische translationale Anwendung der Technologie, die Herausforderungen in der gezielten Verabreichung sowie im Immunschutz gegen die viralen Vektoren adressiert. Zudem werden Strategien zur Begrenzung der Dauer der Base-Editor-Expression erforscht, um potenzielle Langzeitrisiken zu minimieren. Innovative Lieferformen, wie virale und nicht-virale Vektoren oder temporär zellulär exprimierte Editor-Proteine, könnten noch weiter zur Verträglichkeit beitragen. Außerdem ist die Anwendung dieser Editierungsmethoden bei anderen trinukleotidbasierten Krankheiten, wie Friedreich-Ataxie, vielversprechend – dort zielen Adenin-Basen-Editoren darauf ab, GAA-Repeat-Trakte in ähnlicher Weise zu unterbrechen und damit pathologische Expansionen zu verhindern. Die zentrale Bedeutung der genetischen Repeat-Unterbrechungen als Modulatoren des Erkrankungsverlaufes war schon zuvor in epidemiologischen Studien sichtbar: Eine einzelne CAA-Unterbrechung im HTT-CAG-Trakt verzögert den Krankheitsbeginn um durchschnittlich mehr als ein Jahrzehnt.


![Google Map's Transit Layer Is Trash [video]](/images/6B826805-CF25-42F6-A9F3-306FF6F626F6)