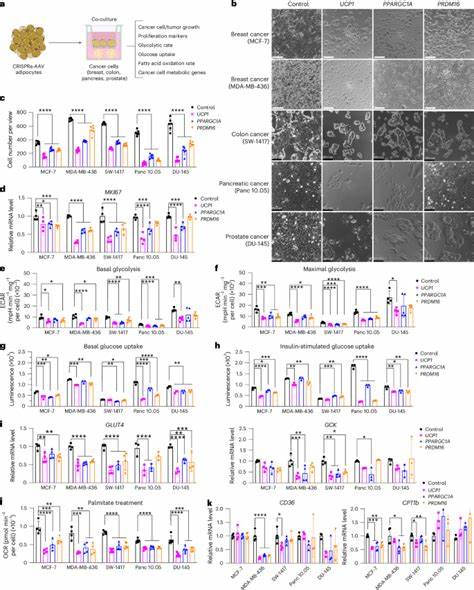
Krebs gehört zu den komplexesten und herausforderndsten Erkrankungen der modernen Medizin. Trotz bewährter Therapieansätze wie Operation, Chemotherapie und Strahlentherapie ist die Suche nach innovativen Strategien zur effektiveren Kontrolle und Behandlung von Tumoren von großer Bedeutung. Aktuelle Forschungen bringen eine faszinierende neue Perspektive ins Spiel: die Nutzung gentechnisch veränderter Fettspeicherzellen – sogenannte Adipozyten – zur gezielten Unterdrückung des Tumorwachstums in verschiedenen Krebsmodellen. Tumoren sind hochgradig metabolisch aktiv und besitzen die Fähigkeit, massiv Nährstoffe aus ihrer Umgebung aufzunehmen und zu verstoffwechseln. Glukose und Fettsäuren bilden hierbei die Hauptenergiequellen, welche die Tumorzellen für ihre schnelle Teilung und ihr Wachstum nutzen.
In hypoxischen und nährstoffarmen Mikroumgebungen, wie sie häufig im Tumorgewebe vorherrschen, passen sich Krebszellen durch Stoffwechselumschaltungen an und steigern ihre Effizienz beim Energiegewinn. Die klassische Methode, solche metabolischen Wege zu hemmen, besteht in der Entwicklung von Medikamenten, die bestimmte Enzyme oder Transportsysteme blockieren. Diese Ansätze zeigen jedoch oft Nebenwirkungen und können durch die bemerkenswerte Anpassungsfähigkeit der Tumorzellen umgangen werden. Vor diesem Hintergrund erscheint die Idee der konkurrierenden Zelltherapie, wie sie durch die Implantation von gentechnisch modifizierten Adipozyten realisiert wird, extrem vielversprechend. Hierbei wird das Prinzip genutzt, dass Adipozyten wertvolle Nährstoffe wie Glukose und Fettsäuren aufnehmen und verstoffwechseln.
Werden diese Zellen so modifiziert, dass sie besonders aktiv und energieverbrauchend sind, können sie gegenüber den Tumorzellen im Wettstreit um Ressourcen überlegen sein. Der innovative Ansatz, genannt Adipose Manipulation Transplantation (AMT), setzt an der Umprogrammierung von weißen Fettzellen zum sogenannten „Browning“ an. Dabei werden weiße Adipozyten in einen Zustand versetzt, der dem von braunem Fettgewebe ähnelt – einem Gewebe, das für seine hohe Energiemobilisierung und thermogene Aktivität bekannt ist. Die Grundlage dieser Umwandlung ist die gezielte Aktivierung von Schlüsselmolekülen wie dem uncoupling protein 1 (UCP1), PPARG coactivator 1 alpha (PPARGC1A) oder PR/SET domain 16 (PRDM16). Insbesondere die Erhöhung der UCP1-Expression steigert die mitochondriale Atmung und Wärmeproduktion, was mit einem erhöhten Verbrauch von Glukose und Fettsäuren einhergeht.
Methodisch wird dazu eine CRISPRa-Technologie (CRISPR-Activation) verwendet, welche die Expressionslevel der Zielgene durch Programmierung eines katalytisch inaktiven Cas9-Proteins, gekoppelt an einen Transkriptionsaktivator, anhebt. Diese gentechnische Modifikation erfolgt in vitro in kultivierten Adipozyten oder sogar in 3D-Adipozytenorganoiden, die danach in unmittelbarer Nähe von Tumoren oder als Koimplantate in Tiermodellen eingeführt werden. Resultate aus präklinischen Studien mit Mausmodellen verschiedenster Krebsarten – darunter Brust-, Pankreas-, Kolon- und Prostatakrebs – demonstrieren eine signifikante Verlangsamung des Tumorwachstums. Dies geht einher mit verringertem Zellproliferationsmarker (wie Ki67), reduzierter Angiogenese und Hypoxie, was insgesamt auf eine weniger aggressive Tumorumgebung schließen lässt. Auch im Zellkulturversuch konnte die BRCA1/2-mutierte Brustkrebsentwicklung durch die co-kultivierten, modifizierten Adipozyten gehemmt werden.
Dies legt die Vermutung nahe, dass diese Strategie nicht nur für etablierte Tumore, sondern auch für präventive Ansätze bei Hochrisikopatienten relevant sein könnte. Ein wichtiges Merkmal dieses Ansatzes ist die Flexibilität und Anpassungsfähigkeit des Systems. So wurde gezeigt, dass durch die Verwendung eines induzierbaren CRISPRa-Systems (z.B. durch Tetracyclin-gesteuerte Expression) die Aktivität der modifizierten Adipozyten kontrolliert und reversible gestaltet werden kann.
Darüber hinaus erlauben neuartige Implantat-Systeme mit biologischen Trägermaterialien (Polymilchsäure-basierte Mikrowellengerüste), dass modifizierte Organoide formstabil, entfernbar und austauschbar eingesetzt werden können, was in klinischen Szenarien eine zusätzliche Sicherheit und Flexibilität bietet. Von besonderer Bedeutung ist zudem die Erweiterbarkeit dieser Methode auf unterschiedliche Tumormetabolismen. So konnte bei einem uridin-abhängigen Pankreaskarzinom durch Aktivierung des Uridin-Phosphorylase 1 (UPP1) Gens in Adipozyten – ebenfalls via CRISPRa – das Wachstum des Tumors angehalten werden. Dies unterstreicht, dass AMT für verschiedene Krebsarten personalisiert und an die jeweilige tumorbedingte Stoffwechsellage angepasst werden kann. Die Mechanismen des Tumorwachstumsstoppes beruhen im Kern auf der Ressourcenkonkurrenz: Modifizierte Adipozyten „verbrauchen“ den Zucker und die Fettsäuren in der Tumorumgebung derart effizient, dass die Tumorzellen in einen metabolischen Engpass geraten.
Dies führt zu einer verminderten Energieversorgung, die die Zellteilung und Metastasierung hemmt. Darüber hinaus konnte beobachtet werden, dass Tiere, die die modifizierten Adipozyten implantiert bekommen, eine verbesserte Glukosetoleranz und Insulinsensitivität aufweisen und niedrigere Plasmaspiegel von Insulin messen lassen. Da Hyperinsulinämie mit einer bewiesenen Förderung des Tumorwachstums verbunden ist, liefert dies eine zusätzliche Erklärung für die tumorhemmende Wirkung. Im Gegensatz zu herkömmlichen Therapieformen könnten durch die AMT-Methode Nebenwirkungen reduziert und vor allem die Wirksamkeit durch das im Körper vorhandene Zellpotential gesteigert werden. Klinisch betrachtet lassen sich Adipozyten durch Liposuktion relativ einfach gewinnen, modifizieren und im gleichen Patienten wieder implantieren, was personalisierte Therapieansätze vereinfacht.
Zudem wird voraussichtlich die Immunantwort geringer ausfallen als bei anderen zellbasierten Therapien, da Adipozyten immunologisch relativ inert sind. Das öffnet auch Perspektiven für die Entwicklung von allogenen „off-the-shelf“ Zelltherapien, die sofort einsatzbereit sind. Wichtig ist, dass noch offene Fragen, wie mögliche Risiken einer Überaktivierung der BAT-ähnlichen Adipozyten zu unerwünschtem Energieverlust oder einer möglichen Förderung der Tumorheterogenität, umfassend untersucht werden müssen. Ebenso bedarf es genauer Studien zur Dosierung, Dauer und Kombination mit bestehenden Therapien. Die Möglichkeit, die gentechnische Aktivität der Modifikationen durch pharmakologische Kontrollmechanismen reversibel zu gestalten oder Implantate bei Bedarf zu entfernen, schafft jedoch eine wichtige Sicherheitsbasis.