Die Behandlung von Krebs stellt bis heute eine der größten Herausforderungen in der Medizin dar. Trotz erheblicher Fortschritte beim Verständnis der Krankheitsmechanismen und der Entwicklung neuer Therapien bleiben viele Krebsarten resistent gegen bestehende Behandlungsmethoden. Eine innovative Forschungsrichtung zielt darauf ab, die Stoffwechselprozesse im Tumormikromilieu zu manipulieren, um damit die Versorgung der Krebszellen zu beeinträchtigen. In diesem Kontext zeigt die Implantation von gentechnisch verändertem Fettgewebe – sogenannter Adipozyten – großes Potenzial zur Hemmung des Tumorwachstums. Adipozyten, also Fettzellen, sind metabolisch äußerst aktive Zellen, die nicht nur Energie speichern, sondern auch eine wichtige Rolle im Energiestoffwechsel und der Signalübertragung im Körper spielen.
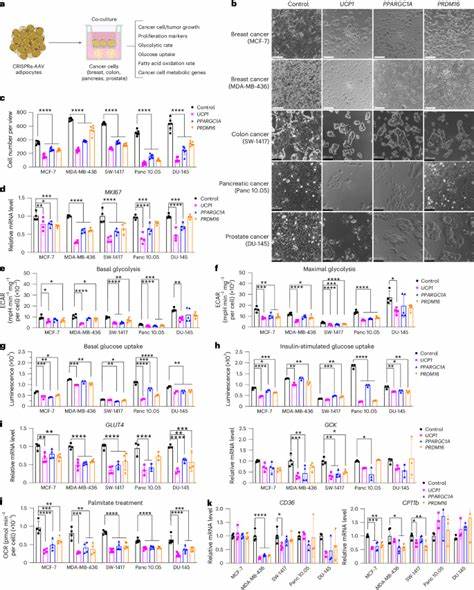
Im Rahmen der neuen Therapieansätze werden diese Zellen so modifiziert, dass sie den Krebszellen im Kampf um Glukose und Fettsäuren metabolisch überlegen sind. Wissenschaftler haben dazu eine Methode entwickelt, bei der durch gezielte Aktivierung spezifischer Gene in den Adipozyten deren Verbrauch von Energiequellen wie Glukose und Fettsäuren gesteigert wird. Eine Schlüsselrolle spielt dabei das Gen UCP1, das für ein Protein kodiert, das den Energieverbrauch durch Wärmeproduktion erhöht, ein Phänomen, das normalerweise bei braunen Fettzellen zu beobachten ist – eine Art von Fettgewebe, das energiereiche Substrate verschwendet, statt sie zu speichern. Durch den gezielten CRISPRa-Einsatz (eine Form der Genaktivierung mittels CRISPR-Technologie) werden weißliche Adipozyten in „beige“ oder braunartige Fettzellen umprogrammiert, welche die Aufnahme von Nährstoffen signifikant erhöhen. Werden diese modifizierten Zellen in unmittelbarer Nähe zu Tumoren implantiert, können sie den Krebszellen entscheidend Nährstoffe entziehen.
Dies baut auf der Beobachtung auf, dass Tumorzellen durch erhöhte Glukoseaufnahme (bekannt als Warburg-Effekt) und Lipidnutzung ihr schnelles Wachstum und ihre Proliferation ermöglichen. Die modifizierten Adipozyten konkurrieren erfolgreich um diese Ressourcen und schränken so die metabolische Leistungsfähigkeit der Tumoren ein. Mehrere Studien, insbesondere an Mausmodellen von Brust- und Bauchspeicheldrüsenkrebs, konnten zeigen, dass die Implantation solcher genetisch manipulierten Adipozyten die Tumorgröße signifikant reduziert. Der umprogrammierte Fettgewebe-Transplantat-Ansatz, der als Adipose Manipulation Transplantation (AMT) bezeichnet wurde, führte in den untersuchten Modellen neben einer Verminderung der Tumorproliferation auch zu einer Abnahme der Angiogenese und des hypoxischen Zustands innerhalb des Tumors. Beides sind wichtige Faktoren, die tumorbedingtes Wachstum und Metastasenbildung begünstigen.
Neben den Vorteilen bei tierexperimentellen Modellen konnte der Therapieansatz auch mit menschlichen Zellen validiert werden. Fettzellen, die aus humanen Brustgewebsproben isoliert und mittels CRISPRa UCP1-aktiviert wurden, zeigten in Co-Kulturen mit Patiententumororganoiden eine erhebliche Hemmung des Zellwachstums. Dies weist auf eine vielversprechende Übertragbarkeit auf klinische Anwendungen und auf die Möglichkeit hin, patienteneigene Fettzellen für eine personalisierte Therapie nutzbar zu machen. Ein weiterer Vorteil dieser Strategie liegt in der hohen klinischen Machbarkeit. Liposuktion und Fetttransplantationen sind etablierte Verfahren insbesondere im ästhetischen und rekonstruktiven Bereich.
Die Idee, autologe Fettzellen außerhalb des Körpers zu modifizieren und zurück zu implantieren, ist somit eine innovative Adaption bewährter Methoden. Die gentechnische Umprogrammierung erfolgt mittels AAV-Transportern, die eine effiziente Transduktion der Fettzellen gewährleisten. Zudem erlauben technische Weiterentwicklungen wie eine induzierbare CRISPRa-Steuerung mit Tetracyclin eine gezielte und reversible Aktivierung der gewünschten Gene nach Implantation. Eine spannende Erweiterung des Ansatzes betrifft die Anpassung des metabolischen Profils der Adipozyten an unterschiedliche Tumorarten. So konnte die Aktivierung des Enzyms UPP1 in Fettzellen die Nutzung von Uridin durch Bauchspeicheldrüsenkarzinome verringern und deren Wachstum somit hemmen – ein Beispiel für die maßgeschneiderte Behandlung basierend auf tumor-spezifischen metabolischen Abhängigkeiten.
Die Mechanismen hinter der Tumorunterdrückung gehen über den direkten Nährstoffwettbewerb hinaus. Studien zeigen, dass die modifizierten Adipozyten auch systemische metabolische Effekte entfalten können, wie eine verbesserte Glukosetoleranz und verminderte Insulinspiegel, was wiederum die Tumorprogression hemmt, da erhöhte Insulinwerte als wachstumsfördernd gelten. Zudem wurde eine niedrigere Hypoxie und geringere Neubildung von Blutgefäßen beobachtet, was die Sauerstoff- und Nährstoffversorgung im Tumorgewebe beeinträchtigt und somit das Wachstum zusätzlich einschränkt. Obwohl die AMT eine vielversprechende Therapie darstellt, gibt es auch Herausforderungen. Ein besonderes Augenmerk muss auf das Risiko der Kachexie gelegt werden, die durch einen gesteigerten Energieverbrauch im Körper ausgelöst werden kann und besonders bei Krebspatienten problematisch ist.
Die Nutzbarkeit eines induzierbaren Systems und das Entfernen der implantierten Zellen über eigens entwickelte Trägersysteme können hier einen wichtigen Sicherheitsmechanismus darstellen. Die breite Anwendbarkeit und Personalisierungsmöglichkeiten von AMT sind besonders hervorzuheben. Adipose Gewebe kann aus verschiedenen Körperregionen gewonnen und je nach Tumorart und Stoffwechselsituation des Patienten passend modifiziert werden. Die Kombination mit bestehenden Therapieformen wie Chemotherapie, Operation oder Immuntherapie eröffnet vielfältige integrative Behandlungsmöglichkeiten, die die klinischen Resultate verbessern können. In Zukunft ist eine Weiterentwicklung hin zu optimierten Genaktivierungen und der gleichzeitigen Beeinflussung mehrerer metabolischer Wege denkbar.



![Watch Humanoid Robot Attacking Workers During Testing in Chinese Factory [video]](/images/DD371A99-7A15-4442-B78B-9BD152B6A057)